

德拉马尼片
德尔巴 DELTYBA
Delamanid Tablets
De la ma ni pian
请仔细阅读说明书并在医师指导下使用
1.为了防止本品耐药菌的产生,应在对结核病治疗有充分知识与经验的医师指导下,与其他治疗耐多药肺结核的药物联合使用。
2.服用本品后,可能会出现QT间期延长。因此,在服药前以及服药期间应定期进行心电图等检查,在权衡风险与获益的基础上,慎重使用。
化学名称:(2R)-2-甲基-6-硝基-2-[(4-{4-[4-(三氟甲氧基)苯氧基]哌啶-1-基}苯氧基)
甲基] -2,3 -二氢咪唑并[2,1-b]噁唑
化学结构式: 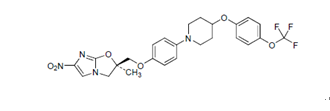
分子式:C25H25F3N4O6
分子量:534.48
本品为薄膜衣片,除去包衣后显白色至淡黄色。
在因耐药或耐受性原因而无法组成有效治疗方案的指征下,本品可作为联合治疗方案的一部分,用于成人耐多药肺结核(MDR-TB)患者的治疗。
应该参考合理使用抗菌药物的官方指南。
50mg
应该由对耐多药结核分枝杆菌控制方面具有丰富经验的医师负责启动德拉马尼治疗并进行监测。
德拉马尼只能作为耐多药肺结核(MDR-TB)联合治疗方案的一部分。根据WHO指南,在24周的德拉马尼治疗阶段结束后应该继续接受联合治疗方案的治疗。
建议通过直接观察治疗(DOT)给予德拉马尼。
剂量
成人:
推荐剂量为每次100 mg,每日两次,连续服用24周。
老年患者(> 65岁):
尚无老年人群用药数据。
肾功能损伤患者:
对于轻度和中度肾功能损伤的患者,无需调整剂量。尚无德拉马尼在重度肾功能损伤患者中的应用数据,因此不建议在该人群使用德拉马尼。
肝功能损伤:
对于轻度肝功能损伤的患者,无需调整剂量。不建议在中度至重度肝功能损伤患者使用德拉马尼。
儿科人群:
德拉马尼在儿童和18岁以下青少年中的安全性和有效性尚不明确。尚无可参考数据。
服药方法
餐后口服。
安全特性总结
下文描述的药物不良反应发生率基于一项涉及481名MDR-TB患者的双盲对照临床试验数据。在该项试验中,321名患者接受了德拉马尼联合最佳背景治疗(OBR)。由于数据集大小有限,因此目前尚不能明确区分下述不良反应到底归因于OBR治疗还是德拉马尼。
已经将心电图QTc间期延长确定为德拉马尼治疗的最大安全性隐患。导致QTc间期延长的主要因素为低白蛋白血症(尤其低于2.8 g/dl)。其他重要药物不良反应还包括焦虑、感觉异常和震颤。
接受德拉马尼治疗的患者中发生率最高的不良反应(发生率>10%)包括恶心(38.3%)、呕吐(33%)和头晕(30.2%)。
不良反应列表
上述双盲对照临床试验中接受德拉马尼治疗的321名患者中至少有1名患者报告了下表中列举的不良反应。药物不良反应的命名依据为MedDRA系统器官分类和首选术语。在每项系统器官分类中,又以不良反应发生率分为很常见(≥1/10)、常见(≥1/100至<1>表:德拉马尼的药物不良反应
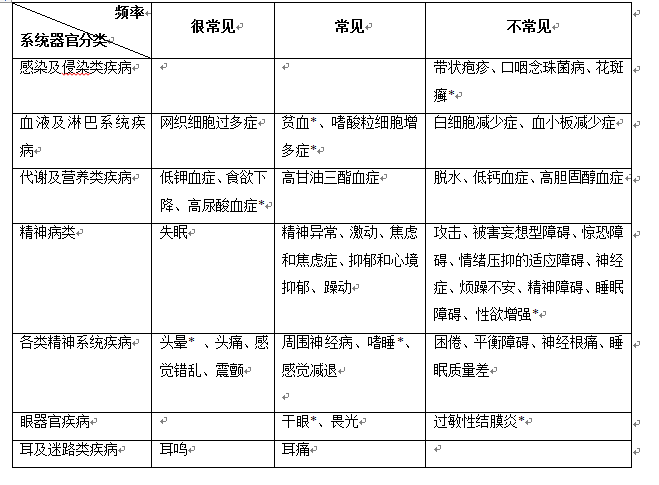


不良反应描述
ECG QT间期延长:
接受德拉马尼(每次100 mg、每日两次)治疗的患者中有9.9%报告了心电图QT间期延长(发生率分类为常见),相比之下接受安慰剂+OBR治疗的患者中只有3.8%报告该事件。
该ADR不伴随临床症状。QTcF间期>500msec的发生率不常见,只在1名患者(1/321)中观察到。无伴发临床症状,该事件得以解决。总体而言,德拉马尼每日两次+OBR组的321名患者中,共有12名患者的QTcF变化幅度>60 ms,相比之下安慰剂+OBR组没有患者(0%)出现QTcF变化幅度>60 ms。低白蛋白血症的存在与QTc间期延长风险增加相关。已经将心电图QTc间期延长确定为德拉马尼治疗的最大安全性隐患。因此在【禁忌】中描述了禁忌症,并在【注意事项】中给出了警告。促成QTc间期延长的主要因素为低白蛋白血症(尤其低于2.8 g/dl)和低钾血症。因此,建议对白蛋白水平、血清电解质和心电图进行高频率监测。
心悸:
服用德拉马尼100 mg + OBR 每日两次的患者,心悸的发生率为8.1%(发生率分类为常见),相比之下服用安慰剂+ OBR 每日两次的患者为6.3%。
1.对本品活性成份或任何辅料有过敏史的患者禁用。
2.血清白蛋白<2.8 g/dL的患者禁用。
3.正在服用CYP3A强诱导剂类药品(如卡马西平)的患者禁用。
4.孕妇或可能妊娠的妇女禁用。
1.没有连续服药24周以上的治疗相关数据。
2.没有治疗以下疾病的临床数据:
- 肺外结核病(例如中枢神经系统、骨骼);
- 结核分枝杆菌复合菌群以外的分枝杆菌导致的感染;
- 结核分枝杆菌潜伏感染。
3.没有关于德拉马尼联合治疗药物敏感性结核分枝杆菌的临床数据。
4.根据WHO建议,德拉马尼必须在MDR-TB的联合治疗方案中使用,以防止产生耐药性。
治疗期间已经出现德拉马尼耐药。当与少数几种具有预期活性的药物和/或当附加药物不属于最有效的抗结核分枝杆菌药物同时使用时,德拉马尼的选择性耐药风险似乎会增加。此外,有限的临床数据表明,在对利福平和异烟肼耐药、但对其他药物敏感的MDR-TB的治疗方案中加入德拉马尼后,疗效最佳,而将德拉马尼用于治疗XDR-TB的最佳治疗方案的一部分时,疗效最差。
5. QT间期延长
在接受德拉马尼治疗的患者中观察到了QT间期延长。在治疗的前6~10周,QT间期延长随时间缓慢增加,之后保持稳定。QTc间期延长与德拉马尼主要代谢产物DM-6705密切相关。血浆白蛋白和CYP3A分别可调节DM-6705的形成和代谢(见下文的特殊注意事项)。
QT间期延长作用的幅度
在一项服用德拉马尼每日两次、每次100mg的MDR-TB患者为对象的安慰剂对照研究中,与基线相比,安慰剂校正后的QTcF平均增加幅度为第1个月7.6 ms,第2个月12.1 ms。试验期间,3%的患者在某些时刻增加幅度达到60 ms或以上,1名患者的QTcF间期>500 ms。无尖端扭转型病例(Torsades de Pointes)或导致心律失常作用的时间相关性事件。
一般建议
建议在德拉马尼治疗开始前获得心电图(ECG)检查结果,在整个德拉马尼治疗期间每月检查一次。如果在德拉马尼首次给药前或治疗期间观察到QTcF >500 ms,则不应开始给药或停止德拉马尼治疗。如果男性/女性患者在德拉马尼治疗期间QTc间期持续时间超过450/470 ms,则这些患者应该接受频率更高的心电图监测。同时还建议在基线时检查血清电解质,例如钾,如果结果异常则进行纠正。
6.特殊注意事项
心脏危险因素
对有以下风险因素的患者不得启动德拉马尼治疗,除非经权衡潜在获益大于潜在风险。此类患者在整个德拉马尼治疗期间应该接受高频率的心电图监测。
1)已知先天性QT间期延长或患任何可延长QT间期的疾病或QTc > 500 ms;
2)症状性心律失常病史或患有临床相关性心动过缓;
3)任何可诱发心律失常的心脏疾病,例如严重高血压、左心室肥大(包括肥厚型心肌病)或充血性心力衰竭伴随左心室射血分数下降;
4)电解质紊乱,尤其是低钾血症、低钙血症或低镁血症;
5)正在服用已知可延长QTc间期的药物。此类药物包括(但不限于):
①抗心律失常药物,例如胺碘酮、丙吡胺、多非利特、伊布利特、普鲁卡因胺、奎尼丁、氢化奎尼丁、索他洛尔等;
②抗精神病药,如吩噻嗪、舍吲哚、舒托必利、氯丙嗪、氟哌啶醇、美索达嗪、匹莫齐特或硫利达嗪,以及抗抑郁药;
③某些抗生素,包括:
-大环内酯类,如红霉素、克拉霉素等;
-莫西沙星、司帕沙星(见【注意事项】关于与其他氟喹诺酮类药物联合用药);
-三唑类抗真菌药;
- 喷他脒;
- 沙奎那韦;
④某些非镇静性抗组胺药,例如特非那定、阿司咪唑、咪唑斯汀等。
6)西沙必利、氟哌利多、多潘立酮、苄普地尔、二苯马尼、普罗布考、左美沙醇、美沙酮、长春碱类、三氧化二砷。
低白蛋白血症
在一项临床研究中,接受德拉马尼治疗的患者中低白蛋白血症的存在可增加QTc间期延长的风险。白蛋白<2.8 g/dL的患者禁止使用德拉马尼。开始接受德拉马尼治疗时血清白蛋白<3.4 g/dL的患者,或在治疗期间血清白蛋白下降至该范围的患者,在整个德拉马尼治疗期间应该接受高频率的心电图监测。
与CYP3A强抑制剂联合使用
德拉马尼与CYP3A强抑制剂(洛匹那韦/利托那韦)联合使用导致代谢产物DM-6705的暴露量增加30%,而该代谢产物暴露量的增加会导致QTc间期延长。因此,如果认为必须要将德拉马尼与任何CYP3A强抑制剂联合使用,则建议在整个德拉马尼治疗期间对患者进行高频率的心电图监测。
德拉马尼与喹诺酮类联合使用
所有QTcF延长超过60 ms的发生都与氟喹诺酮合并用药有关。因此,如果为了组成适当的MDR-TB治疗方案而不可避免地需要联合使用这两类药物,则建议在整个德拉马尼治疗期间对患者进行高频率的心电图监测。
肝功能异常
对于中度至重度肝功能异常患者,不建议使用本品。
HIV感染患者
在接受抗HIV合并治疗的患者中尚无德拉马尼应用经验。
德拉马尼有效性数据的局限性
当前证据除了来自在MDR-TB治疗结束后收集的长期转归结果,还来自一项为期2个月的随机对照试验和一项为期6个月的开放性扩展试验。
生物转化和消除
尚未充分阐明德拉马尼在人体内的完整代谢特征。因此,还不能确切预测德拉马尼可能会发生的具有临床意义的潜在药物相互作用以及可能的后果,包括对QTc间期的总体作用。
辅料
本品中含有乳糖。患有以下疾病的患者不能服用本品:罕见的遗传性半乳糖不耐受、Lapp乳糖酶缺乏以及葡萄糖-半乳糖吸收不良。
7.对驾驶和机械使用的影响
尚未研究对驾驶和机械使用能力的影响。然而,如果患者出现任何可能会影响驾驶或机械使用能力的不良反应(例如头痛和震颤很常见),则建议患者在治疗期间不要驾驶或操作机械。
妊娠
德拉马尼在妊娠女性中的应用数据极其有限。动物研究显示德拉马尼具有生殖毒性。
不建议妊娠女性或育龄期女性使用德拉马尼,除非采取可靠的避孕措施。
哺乳
尚不明确德拉马尼或其代谢产物是否会在人类乳汁中分布。动物试验中的已有药代动力学数据表明德拉马尼和/或其代谢产物可在乳汁中分布。由于不能排除对母乳喂养婴幼儿的潜在风险,因此不建议在德拉马尼治疗期间进行母乳喂养。
生育能力
德拉马尼对雄性和雌性动物的生育能力无影响。
无德拉马尼对人类生育能力影响方面的临床数据。
低出生体重儿、新生儿、婴儿、幼儿或儿童用药的安全性尚未确认。没有18岁以下患者的用药经验。
一般情况下,老年人的生理功能下降,应观察患者状态,慎重用药。
尚未充分阐明德拉马尼的完整代谢过程和消除模式。
其他药品对本品的影响
细胞色素P450 3A4诱导剂
以健康受试者为对象的临床药物相互作用研究表明德拉马尼暴露量下降,在细胞色素P450(CYP)3A4强抑制剂(利福平300 mg、每日一次)与德拉马尼(200 mg、每日一次)合并用药15天后下降幅度达到45%。当德拉马尼(每日两次、每次100 mg)与弱诱导剂依法韦仑(每日一次、每次600 mg、持续用药10天)联合使用时,未观察到临床相关性德拉马尼暴露量下降。
抗HIV药物
以健康受试者为对象的临床药物相互作用研究中,采用了以下给药方法:单独给予德拉马尼(每次100 mg、每日两次)以及与替诺福韦(每次300、每日一次)或洛匹那韦/利托那韦(每次400/100 mg、每日一次)联合使用14天,与依法韦仑联合使用10天(每次600 mg、每日一次)。与抗HIV药物替诺福韦和依法韦仑联合使用时,德拉马尼暴露量保持不变(<25%的差异),但与含有洛匹那韦/利托那韦的抗HIV药物联合使用时,德拉马尼暴露量轻微增加。
本品对其他药品的影响
体外研究表明德拉马尼对CYP450同工酶无抑制作用。
体外研究表明大约在稳态Cmax 5~20倍的浓度范围内,德拉马尼和代谢产物对转运体MDR1(pgp)、BCRP、OATP1、OATP3、OCT1、OCT2、OATP1B1、OATP1B3和BSEP无任何作用。然而,由于肠道内的浓度可能远远高于上述Cmax的数倍,因此德拉马尼可能会对这些转运体产生作用。
抗结核病药品
一项以健康受试者为对象的临床药物-药物相互作用研究中,采用了以下给药方法:单独给予德拉马尼(每次200 mg、每日一次)以及与利福平/异烟肼/吡嗪酰胺(300/720/1800 mg、每日一次)或乙胺丁醇(1100 mg、每日一次)联合使用15天。合并抗TB药物(利福平 [R]/ 异烟肼[H]/ 吡嗪酰胺 [Z])的暴露量不受影响。与德拉马尼联合用药显著增加了乙胺丁醇的稳态血浆浓度,增加幅度大约达25%,临床相关性未知。
抗HIV药品
一项以健康受试者为对象的临床药物-药物相互作用研究中,采用了以下给药方法:单独给予德拉马尼(每次100 mg、每日两次)以及与替诺福韦(300 mg)、洛匹那韦/利托那韦(400/100 mg)联合使用14天,与依法韦仑联合使用10天(每次600 mg、每日一次)。德拉马尼与抗HIV药物替诺福韦、洛匹那韦/利托那韦和依法韦仑联合使用不影响这些药品的暴露量。
可能会延长QTc的药物
已经服用可导致QT间期延长相关药物的患者应慎用德拉马尼。尚未研究莫西沙星和德拉马尼在MDR-TB患者中的联合用药。不建议接受德拉马尼治疗的患者使用莫西沙星。
尚未在临床试验中观察到德拉马尼的过量服药病例。然而,附加临床数据表明,在服药德拉马尼每次200 mg、每日两次(即德拉马尼的每日总剂量400 mg)的患者中,总体安全特性与接受推荐剂量(每次100 mg、每日两次)的患者相当。但是观察到某些反应的发生率较高,且QT间期延长的发生率呈剂量相关性增加。对于过量治疗应该立即采取措施,以便将德拉马尼从胃肠道中清除,并根据需要给予支持性护理。应该实施高频率的心电图监测。
临床研究数据
一项双盲安慰剂对照研究中,161名MDR-TB患者接受了8周的德拉马尼(剂量为每次100mg、每日两次)联合WHO推荐的个性化OBR治疗。下表中列举了在德拉马尼+OBR与安慰剂+OBR治疗组中基线时痰培养阳性患者中观察到的2个月痰培养转阴(SCC)(即由结核分枝杆菌生长变为第2个月无生长):

MGIT®:结核分枝杆菌生长指示管液体培养基系统。
n= 2个月时出现SCC的受试者人数。
药理作用
德拉马尼可抑制结核分枝杆菌细胞壁中分支菌酸的合成。体外试验显示,德拉马尼对多种结核分枝杆菌临床分离株具有抗菌活性,包括对一线治疗药物乙胺丁醇、异烟肼、吡嗪酰胺、利福平和链霉素耐药的菌株;对细胞内结核分枝杆菌和牛型分枝杆菌BCG也有抗菌活性;此外,对引发人类结核病的结核分枝杆菌复合物有抗菌活性,包括结核分枝杆菌、非洲分枝杆菌、牛型分枝杆菌、田鼠分枝杆菌、山羊分枝杆菌和海豹分枝杆菌。德拉马尼在低氧环境中抗结核病的疗效强于其他抗结核病药物。
耐药性
结核分枝杆菌以下5个辅酶F420基因的任一基因缺陷突变均可引起德拉马尼耐药:ddn、fgd、fbiA、fbiB、fbiC。自发性德拉马尼耐药的体外发生频率与异烟肼相似,高于利福平。未见与现阶段使用的抗结核病药物的交叉耐药性。
毒理研究
遗传毒性:德拉马尼Ames试验、小鼠淋巴瘤TK试验、小鼠体内骨髓微核试验和德拉马尼代谢产物DM-6704、DM-6705、DM-6706的Ames试验、大鼠骨髓微核试验结果均为阴性。
生殖毒性:雄性大鼠从交配前14天至交配成功,雌性大鼠从交配前14天至妊娠第6天,经口给予德拉马尼3、30、300mg/kg,未见对生育力以及早期胚胎发育的影响。大鼠妊娠第7天至第17天,经口给予德拉马尼3、30、300mg/kg,未见对妊娠动物和胚胎的影响。兔妊娠第6天至第18天,经口给予德拉马尼20、30mg/kg,母体动物出现死亡;在10mg/kg的可耐受剂量水平下,母体动物可见体重减轻、摄食量减少和轻度出血性改变,早期胚胎吸收率增加。大鼠妊娠第6天至哺乳期第20天,经口给予德拉马尼3、30、300mg/kg,未见对围产期动物一般状态或幼仔生长发育的影响。
致癌性:小鼠和大鼠连续104周经口给予德拉马尼3、30、300mg/kg,未见致癌性变化。
幼年动物毒性:幼年大鼠从第4天开始给药10周,经口给予德拉马尼3、30、300mg/kg,可见APTT或PT延长;300mg/kg剂量下,可见黄体数量减少。
吸收
当与标准餐一起服用时,德拉马尼的口服生物利用度提高,大约是空腹条件下的2.7倍。德拉马尼的血浆暴露增加低于剂量的增加比例。
分布
德拉马尼可高度结合所有血浆蛋白,总蛋白结合率≥99.5%。德拉马尼的表观分布容积较大(Vz/F为2100 L)。
生物转化
德拉马尼主要在血浆中由白蛋白代谢,CYP3A4介导的代谢程度较低。尚未阐明德拉马尼的完整代谢特征,如果发现有效的未知代谢产物,有可能会与其他合并用药发生药物相互作用。已经发现的代谢产物未表现出抗分枝杆菌活性,但某些代谢产物会导致QTc间期延长,主要是DM-6705。已发现的代谢产物的浓度在6-10周后逐渐增加至稳态。
消除
德拉马尼从血浆中的消除t1/2为30~38小时。德拉马尼不经尿液排泄。
特殊人群
儿科人群:
尚未在儿科人群中进行研究。
肾功能异常患者:
从尿液中回收的德拉马尼不足口服剂量的5%。轻度肾功能异常(50 ml/min
轻度肝功能异常患者无需剂量调整。不建议在中度至重度肝功能损害患者中使用德拉马尼。
老年患者(≥ 65岁):
临床试验中未入组≥ 65岁的患者。
遮光、密闭,不超过25℃保存。
双铝PTP包装。每盒60片。
48个月
进口药品注册标准JX20170260
H2018004