

酒石酸托特罗定片
舍尼亭®
Tolterodine Tartrate Tablets
Jiu Shi Suan Tuo Te Luo Ding Pian
本品主要成份为酒石酸托特罗定。
化学名称:(R)-N,N-二异丙基-3-(2-羟基-5-甲基苯基)-3-苯基丙胺L(+)-酒石酸盐。
化学结构式:
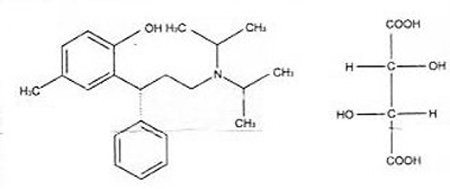
分子式:C22H31NO·C4H6O6
分子量:475.57
本品为薄膜衣片,除去薄膜衣后显白色。
本品适用于因膀胱过度兴奋引起的尿频、尿急或紧迫性尿失禁症状的治疗。
2mg
应在治疗 2-3 个月后再次评价治疗效果。 如果需要减量,可以沿刻痕将片剂分为相等的两半。
给药途径
口服
成人
推荐剂量是每次2mg,每日两次。 可以根据个体反应和耐受性,将剂量从每次2mg 减至1mg,每日两次 。
肾损伤
在肾功能重度受损的患者中(肾小球滤过率 30ml/min),推荐剂量是每次 1mg,每日两次(见注意事项)。
肝损伤
在肝功能受损的患者中,推荐剂量是每次 1mg,每日两次(见注意事项)。
正在服用CYP3A4抑制剂的患者(见药物相互作用)
推荐剂量是每次 1mg,每日两次。
临床数据和上市后临床数据
采用以下惯例对不良反应按发生频率进行排序 :
很常见 ≥1/10
常见 ≥1/100 - <1>不常见 ≥1/1000 - <1>罕见 ≥1/10000 - <1>极罕见 <1>未知 (根据已有数无法估计发生频率)
使用胆碱酯酶抑制剂治疗痴呆的患者
在使用胆碱酯酶抑制剂治疗痴呆的患者中,已经报告了启动托特罗定治疗之后出现痴呆症状加重的病例(如,意识模糊,定向障碍,妄想) 。
儿科患者
在2项III期,随机安慰剂对照双盲的12周儿科研究中,共招募了710名儿科患者,其中接受托特罗定治疗的患者出现尿路感染,腹泻和行为异常的比例高于接受安慰剂治疗的患者(尿路感染:托特罗定6.8%,安慰剂 3.6%; 腹泻:托特罗定3.3%,安慰剂0.9%; 行为异常:托特罗定1.6%,安慰剂0.4%)。
在临床试验中,最常报告的不良反应是口干,头痛的报告也非常常见
感染及侵染类疾病
常见:支气管炎
免疫系统疾病
不常见:超敏反应
未知:过敏样反应
精神系统疾病
不常见:紧张不安
未知:精神混乱状态,幻觉,定向障碍
神经系统疾病
非常常见:头痛
常见:头晕,嗜睡,感觉异常
不常见:记忆力受损
眼疾病
常见:眼干,视觉损伤,包括调节障碍
耳及迷路类疾病
常见:眩晕
心脏疾病
常见:心悸
不常见:心动过速,心力衰竭,心律失常
血管疾病
未知:潮红
胃肠系统疾病
非常常见:口干
常见:消化不良,便秘,腹痛,肠胃胀气,呕吐,腹泻
不常见:胃食管反流疾病
皮肤及皮下组织疾病
常见:皮肤干燥
未知:血管性水肿
肾脏及泌尿系统疾病
常见:排尿困难,尿潴留
全身性疾病及给药部位各种反应
常见:疲乏,胸痛,外周水肿
各类检查
常见:体重增加
以下情况禁忌使用本品:
1. 已知对托特罗定或辅料过敏;
2.尿潴留;
3.胃潴留;
4.未控制的窄角性青光眼;
5.重症肌无力;
6.严重的溃疡性结肠炎;
7.中毒性巨结肠
合并状况:
在以下患者中使用托特罗定时需谨慎:
·显著膀胱出口梗阻,有尿潴留风险;
·胃肠道梗阻疾病,如幽门狭窄;
·肾损伤(见用法用量);
·肝病(见用法用量);
·自主神经病变;
·食管裂孔疝;
·有胃肠活动减少的风险。
有QT间期-延长风险因素的患者
托特罗定速释制剂每日总剂量4mg(治疗)和8mg(超治疗)多次口服给药能够延长 QTc间期。上述发现的临床相关性尚不清楚,并且与患者个体的风险因素和易感性有关。
有QT间期-延长风险因素的患者使用托特罗定时需谨慎,包括:
·先天性或经证实的后天QT间期延长;
·电解质紊乱,如低钾血症,低镁血症和低钙血症;
·心动过缓;
·相关的原有心脏病(即心肌病,心肌缺血,心律失常,充血性心力衰竭)。
尿急和尿频的器质性原因
与所有尿频和急迫性尿失禁的症状治疗一样,应该在治疗前考虑尿急和尿频的器质性原因。
完成判断、运动或认知任务的能力
托特罗定可能会导致眼调节障碍,并且会影响反应时间,因此可能会对驾驶和操作机器的能力产生不良影响。
生育力
没有相关资料。
妊娠
不建议在妊娠期间使用托特罗定。
没有托特罗定用于妊娠期女性的充分数据。
动物研究显示存在生殖毒性。对人体的潜在风险未知。
哺乳期
应避免在哺乳期间使用托特罗定。
没有托特罗定是否会分泌至人乳汁中的相关数据。
不建议托特罗定用于儿童。
尚未在儿童中确定托特罗定的疗效。
在老年人中,无需调整托特罗定剂量。
接受托特罗定治疗的老年和年轻患者之间没有观察到总体安全性差异。
已知会延长QT-间期的药物
托特罗定在同时使用已知会延长QT-间期药物的患者中用药需谨慎,包括IA类(如,奎尼丁,普鲁卡因胺)和III 类(如 胺碘酮,索他洛尔)抗心律失常药物(见注意事项)。
强CYP3A4 抑制剂
不建议与强CYP3A4抑制剂,如大环内酯抗生素(如,红霉素和克拉霉素),抗真菌药(如,酮康唑,咪康唑和伊曲康唑)和抗蛋白酶合并全身给药,因为托特罗定在 CYP2D6弱代谢者中的血清浓度会升高,(之后)出现过量的风险(见药物过量)。
具有抗毒蕈碱特性的药物
与其他具有抗毒蕈碱特性的药物合用可能会导致更显著的治疗效果和不良反应。相反,与毒蕈碱胆碱能受体激动剂合用可能会减少托特罗定的治疗效果。
促动力药
托特罗定可能会减少促动力药的作用,如甲氧氯普胺和西沙必利。
氟西汀
与氟西汀(一种强效CYP2D6抑制剂)合并治疗没有导致临床显著的相互作用,因为托特罗定与其CYP2D6-依赖性代谢产物,5-羟甲基托特罗定具有同等效力。
华法林或复方口服避孕药
药物相互作用研究显示,与华法林或复方口服避孕药(炔雌醇/左炔诺孕酮)之间不存在相互作用。
经同工酶 CYP2D6, 2C19, 2C9, 3A4 或1A2代谢的药物
临床研究已经表明,托特罗定不是 CYP2D6, 2C19, 2C9, 3A4 或 1A2 的代谢抑制剂。因此,与托特罗定联合给药时,经上述同工酶代谢的药物血浆水平预期不会增加。临床研究显示本品与华法林或口服避孕药(左炔诺孕酮/炔雌醇)合并给药无相互作用。
在人体研究中,志愿者单次口服酒石酸托特罗定的最高剂量是12.8mg 。
症状和体征
观察到的最严重不良事件是眼调节障碍和排尿困难。
其他症状包括:
重度中枢抗胆碱能作用(如,幻觉、重度兴奋);
惊厥或显著兴奋;
呼吸功能不全;
心动过速;
尿潴留;
瞳孔散大。
托特罗定速释制剂每日总剂量8mg(速释制剂推荐日剂量的2倍,并且相当于缓释制剂暴露峰值的3倍)连续给药4天后,观察到QT间期延长。
治疗
如果发生托特罗定用药过量,应给予活性炭治疗。
对症治疗如下:
重度中枢抗胆碱能作用(如,幻觉,重度兴奋):毒扁豆碱;
惊厥或显著兴奋:苯二氮卓类;
呼吸功能不全:人工呼吸;
心动过速:β-阻滞剂;
尿潴留:导管插入;
瞳孔散大:毛果芸香碱滴眼剂和/或将患者置于暗室。
如果出现托特罗定用药过量,应采取QT间期延长的标准支持性措施。
药理作用
托特罗定是一种选择性、特异性的毒蕈碱性受体拮抗剂,在体内对膀胱的选择性高于涎腺。托特罗定的代谢产物之一(5-羟甲基衍生物)具有与母体化合物相似的药理学特征。
毒理研究
遗传毒性:
托特罗定Ames试验、体外染色体畸变试验、小鼠微核试验结果均为阴性。
生殖毒性:
在小鼠,未见托特罗定对生育力或生殖功能的明显影响。当托特罗定的血浆暴露(Cmax或AUC)高于人体治疗血浆暴露的20或7倍时,可见胚胎死亡和畸形。托特罗定兔体内的血浆暴露(Cmax或AUC)比人体治疗剂量时的血浆暴露高20或30倍时,未见胚胎-胎仔生长发育毒性。妊娠小鼠给药剂量为20mg/kg/d时(约为临床治疗剂量暴露量的14倍),未见子代生长发育毒性;30-40mg/kg/d 时(约为人体暴露的20-25倍),可见胚胎死亡率增加,胎仔重量下降,胎仔畸形发生率增加(腭裂,趾畸形,腹腔内出血和多种骨异常,主要是骨化作用减少)。妊娠兔皮下注射给药约达临床暴露量的3倍时(0.8mg/kg/d),未见胚胎-胎仔生长发育毒性, AUC 大约为 100ug.h/L。
托特罗定及其人体活性代谢产物可延长犬心脏浦氏纤维动作电位持续时间(90%复极化),为治疗水平的14-75倍,阻断hERG K+电流,为治疗水平的0.5-26.1倍。延长QT间期,为治疗水平的3.1-61.0倍。上述发现的临床相关性尚不清楚。
吸收
托特罗定吸收迅速。托特罗定及其5-羟甲基代谢产物的血清浓度在给药后1-3小时达到最大。在强代谢者中,托特罗定片剂的半衰期是2-3小时,在弱代谢者中(缺乏CYP2D6)大约是10小时。在片剂给药后2天内达到稳态浓度 。
生物利用度
在强代谢者(大部分患者)中,托特罗定的绝对生物利用度是17 % ,在弱代谢者中(缺乏CYP2D6)是65%。
在强代谢者中,食物没有影响游离托特罗定及其活性5-羟甲基代谢产物的暴露,虽然与食物同服时托特罗定的水平有所增加。同样,在弱代谢者中预期也不会发生临床相关变化。
分布
托特罗定及其5-羟甲基代谢产物主要与血清类粘蛋白结合。游离分数分别是3.7% 和36%。托特罗定的分布容积是113 L。
代谢
托特罗定口服给药后经过广泛的肝脏代谢。主要代谢途径是经由具有多态性的酶CYP2D6 介导,并形成5-羟甲基代谢产物。之后进一步代谢形成5-羧酸和N-脱烷基5-羧酸代谢物,这两种物质在尿液回收的代谢产物中分别占51% 和29% 。有一部分人群(约 7%)缺乏 CYP2D6 活性。在这类个体(弱代谢者)中已确定的代谢途径是通过CYP3A4 的脱烷基化作用形成N-脱烷基托特罗定,该物质对临床疗效没有作用。其余人群都属于强代谢者。托特罗定在强代谢者中的全身清除率约为30L/h。在弱代谢者中,清除率下降导致托特罗定的血清浓度显著升高(约7倍),而观察到的5-羟甲基代谢产物浓度极低。
5-羟甲基代谢产物具有药理学活性,并且与托特罗定的效力相同。由于托特罗定和5-羟甲基代谢产物的蛋白结合特征存在差异,在相同剂量方案条件下,游离托特罗定在弱代谢者中的暴露(AUC)与游离托特罗定和5-羟甲基代谢产物在具有CYP2D6活性患者中的合并暴露相似。在不同基因型的患者中,安全性,耐受性和临床反应相似 。
消除
14C-托特罗定给药后放射活性通过尿液排泄的比例约为77%,通过粪便排泄的比例约为 17% ,回收的原形药低于剂量的1%,5-羟甲基代谢产物占剂量的4%。羧化代谢产物和相应的脱烷基代谢产物的尿液回收率分别是51% 和29% 。 托特罗定的消除半衰期(t1/2)是2-3小时。 在治疗剂量范围内,药代动力学呈线性。
特殊患者人群
儿童
在成人和青少年中,每毫克剂量的活性部分暴露相似。在5-10岁儿童中,每毫克剂量的活性部分平均暴露大约比成人高2倍。 老年人
在多剂量研究中,托特罗定速释制剂日剂量 4mg(2mg 每日两次)给药后,托特罗定和5-HMT在健康老年志愿者(64-80岁)中的血清浓度与健康年轻志愿者(小于40岁)相似 。在另一项临床研究中,老年志愿者(71-81岁)接受托特罗定速释制剂日剂量 2 或 4mg(1 或2mg 每日两次)给药。托特罗定和5-HMT在这些老年志愿者中的平均血清浓度分别比年轻健康志愿者高20%和50%。但是,在为期12周的3期对照临床研究中,没有观察到接受托特罗定治疗的老年和年轻患者之间有总体安全性差异。
肾损伤
游离托特罗定及其5-羟甲基代谢产物的平均暴露在重度肾损伤(菊糖清除率GFR 30ml/min)患者中增加1倍。其他代谢产物的血浆水平在这些患者中显著增加(最高达到12倍)。这些代谢产物增加的临床相关性尚不清楚。 没有轻至中度肾损伤患者用药的相关资料。
肝损伤
游离托特罗定和5-羟甲基代谢产物的暴露在肝硬化受试者中增加2倍。
遮光,密闭保存。
铝塑包装,10片/板/盒,14片/板/盒,2×14片/板/盒。
暂定24个月
WS-514(X-446)-2000
国药准字H20000602
FDA妊娠分级:C