

注射用醋酸亮丙瑞林微球
抑那通 Enantone
Leuprorelin Acetate Microspheres for Injection
Zhu She Yong Cu Suan Liang Bing Rui Lin Wei Qiu
化学名称:5-氧代-脯氨酰-组氨酰-色氨酰-丝氨酰-酪氨酰-D-亮氨酰-亮氨酰-精氨酰-N-乙基-脯氨酰胺醋酸盐。
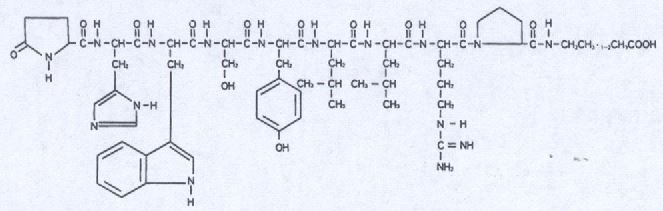
分子式:C59H84N16O12·C2H4O2
分子量:1269.45
辅料:
注射用无菌粉末:
共聚物(DL-乳酸/羟基乙酸)(3:1)和D-甘露醇
注射用溶媒:
D-甘露醇、羧甲基纤维素钠、吐温80和注射用水
本品为白色粉末。
1.88mg(以醋酸亮丙瑞林计)
3.75mg(以醋酸亮丙瑞林计)
1.子宫内膜异位症:通常情况下,成人每4周1次,每次3.75mg,皮下注射。初次给药应从月经周期的第1~5日开始。
2.子宫肌瘤:通常情况下,成人每4周1次,每次1.88mg,皮下注射。但对于体重过重或子宫明显增大的患者,应皮下注射3.75mg。初次给药应从月经周期的第1~5日开始。
3.前列腺癌、雌激素受体阳性的绝经前乳腺癌:通常情况下,成人每4周1次,每次3.75mg,皮下注射。
4.中枢性性早熟症:通常情况下,每4周1次,剂量范围为30-l80μg/kg,皮下注射,可根据患者性腺轴抑制情况进行适当调整。
使用说明:
瓶装规格:给药前,应用附加的1ml溶媒将瓶内药物充分混悬,注意勿起泡沫。
预充式注射器规格:给药前先将注射针朝上,然后推动柱塞杆,将全部的溶媒完全推进至药物粉末中,充分混悬后使用,注意勿起泡沫。使用预充式注射器,就不可能对注射剂量再进行调整。因此,只有当患者需要一次性使用全部药物盈的时候才能使用它。
下表显示了包括实验室检查值异常在内的不良反应发生率,是根据适应症和研究类型划分的。
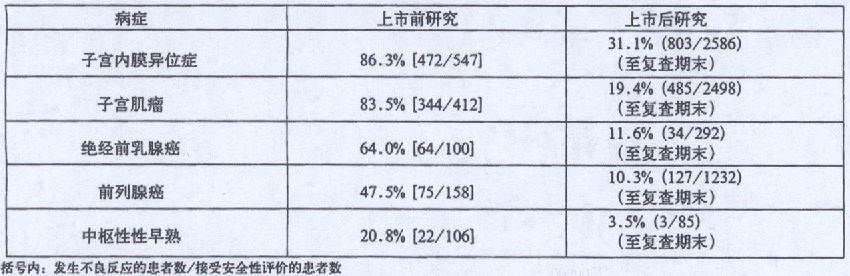
下列不良反应来自以上调查或自发报告。
由于本品为缓释制剂,所以在最后一次给药之后,在药物疗效的持续期间,应该对患者的情况进行观察.
1.临床上重要的不良反应
1)可能出现伴有发烧、咳嗽、呼吸困难、胸部X-射线片异常等的间质性肺炎症状(<0.1%),此时应密切观察患者的状态。如观察到有任何异常,应采取适当的措施如用肾上腺皮质激素进行治疗等。
2)由于可能出现过敏样症状(<0.1%),故用药前应仔细询问患者的过敏史,用药后要密切观察。如观察到有任何异常,应采取适当的措施。
3)由于可能出现伴AST、ALT值升高的肝功能障碍或黄疸(发生率未知),应密切观察患者的状态,如果发生这类状况应采取适当的处置。
4)由于可能引发或加重已有糖尿病症状(发生率未知),治疗期间应密切监测患者血糖或糖化血红蛋白(HbAlc)水平,如果发生这类状况应按照当前临床实践采取适当的措施。
5)在患有垂体腺癌的忠者中有发生垂体卒中的报道(发生率未知)。因此,如在第一次给予本药后立即出现头痛、视觉损伤、视野异常等症状,应在检查后采取适当的措施,例如外科治疗等。
6)可能出现血栓栓塞事件,如心肌梗死、脑梗死、静脉血栓、肺栓塞(发生率未知)。因此,应密切观察,如有任何异常,应采取适当措施,如停止给药。
7)在用于治疗子宫内膜异位症和子宫肌瘤时,由于患者血中的雌激素水平降低而出现更年期综合征样的精神抑郁状态(0.1—<5%),应密切观察患者的状态。
8)在用于治疗前列腺癌时,因可能出现精神抑郁,应密切观察患者的状态。由于本品对垂体-性腺系统的刺激作用而引起的血清睾酮浓度暂时升高,并发骨疼痛一过性加重,泌尿道梗阻或脊髓压迫(≥5%)。遇到这种情况应进行对症治疗等适当处理。
9)在接受GnRH激动剂治疗的男性患者中有报道心肌梗死、心源性猝死和休克的风险增加。本品在用于前列腺癌治疗时,可能会出现心力衰竭(0.1一<5%),应仔细评估伴发心血管疾病的风险。治疗期间应密切监测可能提示心血管疾病的症状和体征,如果出现这类情况应按照当前临床实践采取适当措施。
10)接受睾丸切除术和GnRH激动剂类似物治疗的男性患者中有报道骨密度下降,因此接受本品长期治疗的患者应注意监测骨密度。
2.其它不良反应
在子宫内膜异位症、子宫肌瘤、绝经前乳腺癌和中枢性性早熟适应症中观察到的不良反应
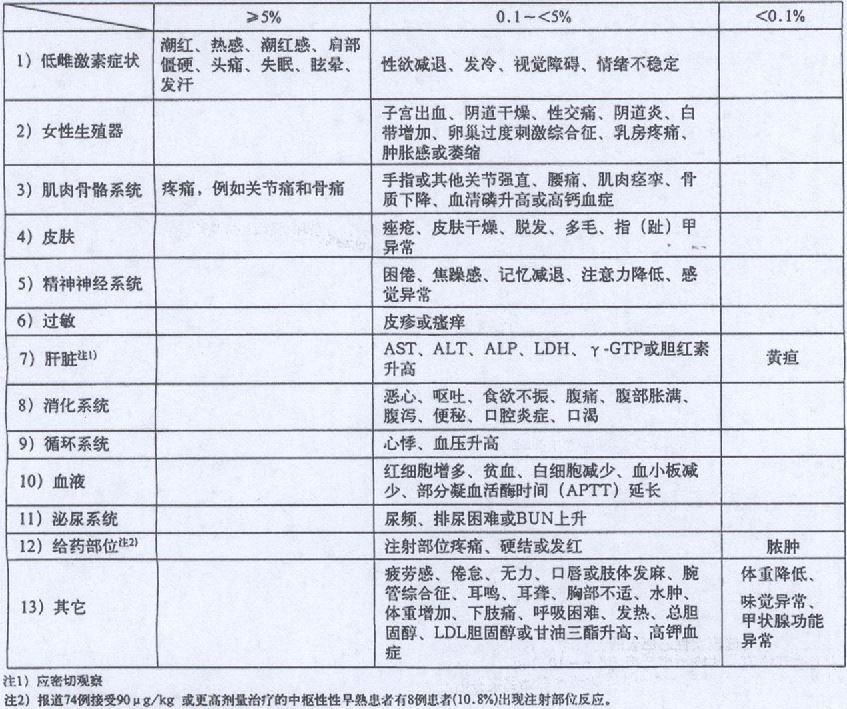
在前列腺癌适应症中观察到的不良反应:

下列患者禁用本品



1.慎重用药(对下述患者应慎用给予本品)

2.重要的注意事项

3.使用时注意事项
(1)给药途径
本品只作为皮下给药[静脉注射可能会引起血栓形成]
(2)给药方法
1)注射针头用7号或更粗者,预充式注射器已配备了针头。
2)皮下注射时注意下列几点:
①注射部位应选择上臂、腹部或臀部的皮下。
②注射部位应每次变更,不得在同一部位重复注射。
③检查注射针头不得扎入血管内。
④嘱咐患者不得按摩注射部位。
(3)配制
1)临用时配制,混悬后立即使用。
2)在混悬液中发现有沉积物,轻轻振荡使颗粒再度混悬均匀后使用,避免形成泡沫。
4.其它注意事项
有报告称,在大鼠的动物实验中,以醋酸亮丙瑞林0.8、3.6、16mg/kg/4周皮下注射1次,共给药1年,或用醋酸亮丙瑞林水溶液注射剂0.6、1.5及4mg/kg/日,同样给药2年,发现有良性垂体腺瘤的发生。
中枢性性早熟
本品对低体重儿、新生儿和乳儿的安全性尚未确定。
通常,老年患者的生理功能会减退,因此应谨慎给予本品。
子宫内膜异位症、子宫肌瘤
药物配伍注意对事项(当本品与下列药物配伍使用时,应谨慎用药)

尚缺乏本品药物过量的研究资料。
以下数据均来自国外研究
子宫内膜异位症
在对子宫内膜异位症忠者的研究中,皮下注射醋酸亮丙瑞林3.75mg或1.88mg,每4周给药一次,共6次。第24周的整体改善率列于下表中.其中给予醋酸亮丙瑞林3.75mg的患者,改善率(显著改善+改善)为79.9%。
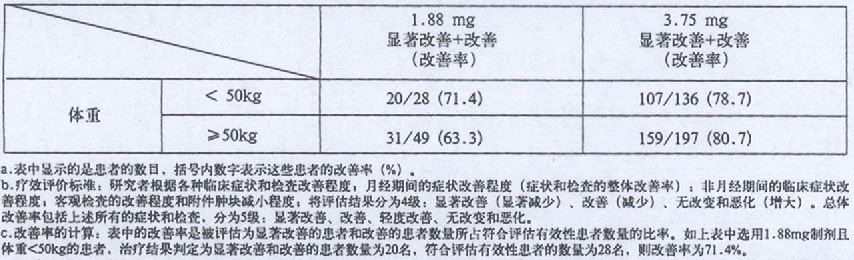
与3.75mg的醋酸亮丙瑞林相比,1.88mg的临床效果则要略低。然而,在体重小于50kg的患者身上得到的数据表明1.88mg的改善率与3.75mg的几乎是相同的。在进一步的临床研究中,对体重小于50kg的子宫内膜异位症患者皮下注射醋酸亮丙瑞林l.88mg,每4周给药一次,共6次。最终得到的改善率(显著改善+改善)为82.0%(共50名患者,其中41人病情得到了改善)。
子宫肌瘤
在一项对子宫肌瘤患者的研究中,皮下注射醋酸亮丙瑞林3.75mg或1.88mg,每4周给药一次,共4次或6次。除了那些难以确定的病例外,最后一次给药后的笫4周的整体改善率(显著改善+改善)和显著改善事分别为83.5%(259/310名患者)和39.7%(123/310名患者)。下表显示了按照剂量、体重和给药前子宫的大小(通过阴道检查)所进行的分层分析得到的改善牢(显著改善+改善)结果。在那些体重较重的(≥55kg)或者子宫显著扩大的(拳头大小或者更大)患者中,给予3.75mg醋酸亮丙瑞林得到的改善率要高于1.88mg组。

对子宫肌瘤症患者进行的双盲比较研究已经证明了醋酸亮丙瑞林的有效性。与此同时,在一项剂量设定研究中,分别皮下注射醋酸亮丙瑞林0.94mg、1.88mg、3.75mg和5.63mg,共四次,包括实验室检查值异常在内的不良反应发生率分别为72.9%(35/48)、80.0% (36/45)、90.7% (39/43)和87.8% (43/49)。
绝经前乳腺癌
在一项对绝经前乳腺癌患者的研究中,皮下注射醋酸在丙瑞林3.75mg,每4周给药一次,共3次。在第12周,在病例完整的患者中有效率(CR+PR)为30.4% (14/46),在可评估病例中为28.6% (14/49)。此外,12周后继续单独给予本品,病例完整和可评估病例的患者(包括长期给药进行评估的患者和第12周评估结束的患者)中的有效率* (CR+PR)分别为37.0% (17/46)和34.7% (17/49)(※评估基于在整个观察期中记录的“最佳缓解”)。[按照“进展期和复发的乳腺癌的治疗有效性的评估标准——日本乳腺癌协会抗癌反应委员会标准”进行评价(CR:完全缓解(显著有效),PR:部分级解(有效))].
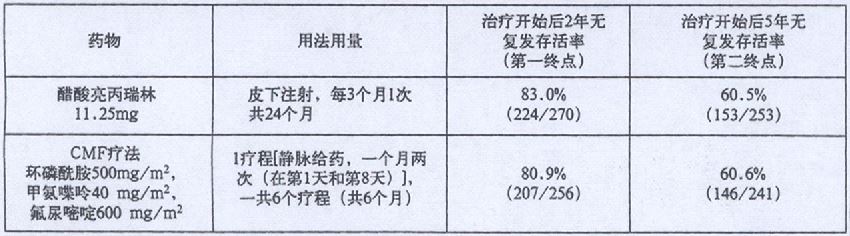
在一项欧洲进行的随机对照研究中,淋巴结转移阳性并处于(绝经前/围绝经期乳腺癌)术后状态的患者接受皮下注射醋酸亮丙瑞林11.25mg,每3个月给药一次治疗或者是CMF治疗,该研究中无复发的存活率列于下表。
前列腺癌
在一项对前列腺癌患者的研究中,皮下注射醋酸亮丙瑞3.75mg,每4周给药一次,共3次。在第12周,在病例完整的患者中有效率(CR+PR)为53.9% (55/102),在可评估病例中为48.2% (55/114)。在一项长期的临床研究中,对单独接受本品持续治疗的患者进行皮下注射,每4周给药一次,共5至46次不等,对比可评估病例,完成的病例有效率※(CR+PR)为51.7%(15/29) (※评估基于在整个观察期中记录的“最佳缓解”)。[按照“前列腺癌药物治疗有效性的评估标准——日本前列腺癌临床有效性研究组标准”进行评价(CR:完全缓解(显著有效),PR:部分缓解(有效))]。
中枢性性早熟
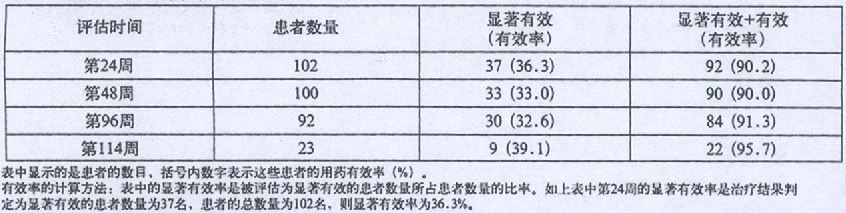
在一项对中枢性性早熟患者的研究中,皮下注射醋酸亮丙瑞林30μg/kg到90μg/kg,每4周给药一次。第24周、48周、96周和114周的有效率列于下表中:
180μg/kg使用的回顾性研究数据
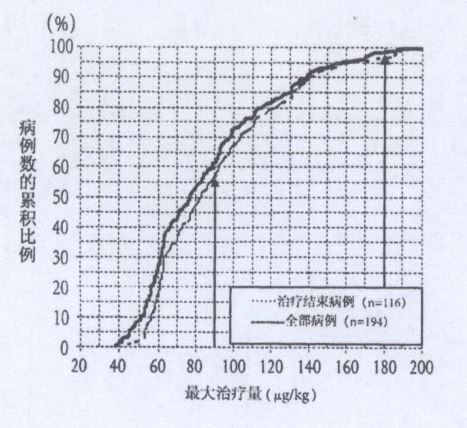
在一项针对中枢性性早熟性腺抑制疗法中醋酸亮丙瑞林治疗量进行的回顾性研究中,在116例治疗结束的病例中最大给药量超过90μg/kg的病例有51例(44.0%)。由于治疗贷的增加导致超过90μg/kg的病例有41例(35.3%)。增量后超过90μg/kg的LH基础值与增量前相比较低,而且给药结束时,发现与治疗开始时的△骨龄/△实足年龄值为 0.43,骨龄的进化得到了抑制。对于以剂量90μg/kg以下进行治疗时治疗效果不明显的大多数病例来说,通过最大给药量增至180μg/kg而得到了明显的治疗效果。此外,也没有因增量超过90μg/kg而发现新的安全性问题。
药理作用:
1.对垂体-性腺系统的抑制作用
醋酸亮丙瑞林是高活性的促性腺激素释放激素(GnRH)衍生的类似物。重复给予大剂量的GnRH或其高活性衍生物醋酸亮丙瑞林,在首次给药后能立即产生一过性的垂体-性腺系统兴奋作用(急性作用),然后抑制垂体生成和释放促性腺激素。它还进一步抑制卵巢和睾丸对促性腺激素的反应,从而降低雌二醇和睾酮的生成(慢性作用)。醋酸亮丙瑞林的促黄体生成激素(LH)释放活性约为天然GnRH的100倍,它的抑制垂体-性腺系统功能的作用也强于天然GnRH。由于它对蛋白分解酶的抵抗力和对GnRH受体的亲和力都比内源性GnRH强,所以能有效地抑制垂体-性腺系统的功能。此外,注射用醋酸亮丙瑞林微球又是一种缓释制剂,它可恒定地向血液中释放醋酸亮丙瑞林,故能持续有效地降低卵巢和睾丸的反应,产生持续的垂体-性腺系统的抑制作用。
2.对性腺激素浓度的抑制作用
(1) 对子宫内膜异位症、子宫肌瘤或绝经前乳腺癌患者,每4周1次皮下注射醋酸亮丙瑞林,使血清中雌二醇下降到接近绝经期的水平。因此本品有卵巢功能抑制作用,可抑制正常排卵和使月经停止。
(2) 对前列腺癌患者皮下注射醋酸亮丙瑞林,每4周1次,使血清睾酮浓度降至去势水平之下,表明本品有药物性的去势作用。
(3) 对患有中枢性性早熟的男孩和女孩每4周1次,皮下注射醋酸亮丙瑞林后,血清中促性腺激素的水平降至青春期前的水平,表明对第二性征有进行性抑制作用。
毒理研究
1.小鼠和大鼠皮下注射醋酸亮丙瑞林的LD50均大于100mg/kg.口服给药未测出LD50;大剂量醋酸亮丙瑞林可引起大鼠呼吸困难、活动减少。
2.醋酸亮丙瑞林微球注射到大鼠的脑部,未观察到脑组织坏死和神经系统方面的毒性反应。
3.大鼠皮下注射醋酸亮丙瑞林0.6-4mg/kg,连续给药24周,观察致癌性,结果出现垂体良性增大,良性垂体腺癌。雌性大鼠胰岛细胞腺瘤明显增加,雄性大鼠睾丸间质细胞腺瘤也明显增加。
4.在细菌和哺乳动物进行致突变试验,未见有致突变作用。
5.怀孕后家兔给予醋酸亮丙瑞林0.24、2.4、24μg/kg(相当人剂量的1/300至1/3),结果见家兔胎儿发育异常,2.4、24μg/kg剂量组的家免胎儿死亡率增加和体重降低,怀孕大鼠给予醋酸亮丙瑞林后,24μg/kg剂量组大鼠胎儿也出现死亡率增加和体重降低现象。
吸收 一项在健康女性志愿者的药代动力学研究结果显示,单次肌肉注射醋酸亮丙瑞林微球3.75mg后4小时血浆药物浓度达到峰值,其峰浓度范围为4.6-10.2ng/ml,但在研究中未能对原型醋酸亮丙瑞林和它的无活性代谢产物加以区分。此后在2天之内,药物的血浆浓度开始稳定在0.30ng/ml,这一稳态血药浓度可相对稳定的维持4-5周。
分布 一项在健康男性志愿者的研究结果显示,静脉注射时,药物的平均稳态分布容积为27L,体外试验表明,药物与人血浆蛋白的结合率范围在43%-49%。
代谢 在健康男性志愿者的研究显示,用1mg的药物静脉注射,药物的平均系统清除率为7.6L/h,终束消除的半衰期接近3小时,符合二室模型。
在大鼠和犬的研究表明,给动物投入14C标记的亮丙瑞林,药物被代谢降解为一些无活性的多肽片段,包括五肽(代谢物1)、三肽(代谢物2和3)和二肽(代谢物4)。这些多肽片段也将进一步降解。五肽是药物主要的代谢产物。
在对5例前列腺癌病人的研究中,药物主要代谢产物五肽(M-l)的血浆浓度在给药后2-6小时达到最大浓度,为其原型药血浆浓度的6%,给药一周后,五肽(M-1)的平均血浆浓度可按近原型药物浓度的20%。
排泄 在3例病人的研究中显示,注射醋酸亮丙瑞林微球3.75mg,至少5%以原型和代谢产物l(M-l)的形式从尿中排泄。
子宫内膜异位症
1)血药浓度
图1显示在一项对子宫内膜异位症患者的研究中,皮下注射醋酸亮丙瑞林3.75mg或1.88mg,每4周一次,共6次的血中药物浓度。在77例子宫内膜异位症患者皮下给予醋酸亮丙瑞林3.75mg,每4周共6次,原型药物和代谢物M-I*的血浓度显示没有蓄积作用。
*M-I:酪-D-亮-亮-精-脯氨酰胺乙基

2)尿中排泄
下表显示了对子宫内膜异位症患者皮下给予醋酸亮丙瑞林3.75mg,每4周一次,共6次,在首次给药后24小时和第6次给药后24小时,尿中原型药物及代谢物M-1的排出率(%)。

子宫肌瘤
子宫肌瘤患者的药代动力学与子宫内膜异位症患者体内的药代动力学相同,子宫肌瘤与子宫内膜异位症都是雌激素依赖性疾病,二者几乎发生在相同的年龄段。
绝经前乳腺癌
绝经前乳腺癌患者给予醋酸亮丙瑞林3.75mg,每4周一次,共3次皮下注射时原型药物的血中浓度如图2所示。在第2次和第3次注射的4周后血中浓度比第1次注射的4周后的血中浓度略低,说明无蓄积性。

前列腺癌
1)血药浓度
图3表示给前列腺癌患者皮下1次注射醋酸亮丙瑞林3.75mg后原型药物的血药浓度。给前列腺癌患者(17例)皮下注射醋酸亮丙瑞林3.75mg,每4周一次,共3次,血中原型药物浓度显示本品在体内无蓄积性。

2)尿中排泄
给前列腺癌患者(2例)1次注射醋酸亮丙瑞林3.75mg,给药后观察28天原型药物及代谢物M-1在尿中排出率分别为2.9%和1.5%。
中枢性性早熟症
1)血药浓度
对中枢性性早熟患者皮下注射醋酸亮丙瑞林30mg/kg,每4周一次,共12次,图4表示首次给药后原型药物的血中浓度。根据原型药物的血浓度变化趋势判断本品在体内无蓄积性。

2)尿中排泄
对中枢性性早熟症患者(1例)皮下注射醋酸亮丙瑞林30mg/kg,至用药后第28日止,原型物及代谢物M-I的尿中排泄率分别为1.8%和7.1%。
特殊人群
对于有肝脏和肾脏疾病的病人,尚未进行药代动力学研究.
密封室温(10-30℃)保存保存
瓶装规格:西林瓶,1瓶/盒。每瓶附带注射用溶媒1支(1ml),安瓿包装。
预克式注射器规格:l支/盒(预充式注射器,前室为药物无菌粉末,后室为lml溶媒。)
36个月
瓶装规格:进口药品注册标准JX20070185 预壳式注射器规格:进口药品注册标准JX20070245
瓶装规格:
(1)1.88mg:国药准字J20090037
(2)3.75mg:国药准字J20090036
预宽式注射器规格:
(1)1.88mg:国药准字J20090052
(2)3.75mg:国药准字J20090053
瓶装规格:
(1) 1.88mg:BH20080633
(2) 3.75mg:BH20080634
预觅式注射器规格:
(1) 1.88mg:H20090294
(2) 3.75mg:H20090293
FDA妊娠分级:X