

注射用醋酸奥曲肽微球
善龙® Sandostatin LAR®
Octreotide Acetate Microspheres for Injection
Zhu She Yong Cu Suan Ao Qu Tai Wei Qiu
本品活性成分为醋酸奥曲肽。
化学名称:醋酸奥曲肽
化学结构式: 
分子式 :C49H66N10O10S2,nCH3COOH
分子量 :1019.3(按游离肽计)
本品所含辅料为:粉末:无菌甘露醇、DL-丙交酯-co-乙交酯共聚物;溶剂:羟甲基纤维素钠、甘露醇、注射用水。
本品为白色或类白色粉末。
●肢端肥大症
用于下列肢端肥大症患者的治疗:
—皮下注射善宁已充分控制病情。
—不适合外科手术、放疗或治疗无效的患者,或在放疗充分发挥疗效前,处于潜在反应阶段的患者(见剂量/用法)
●胃肠胰内分泌肿瘤
伴有功能性胃肠胰内分泌肿瘤症状的患者,已经用皮下注射善宁治疗得到充分控制。
—伴有类癌综合征特征的类癌。
—血管活性肠肽瘤
—胰高糖素瘤
—胃泌素瘤/卓-艾综合征
—胰岛素瘤(用于术前低血糖的控制和维持治疗)
—生长激素释放因子腺瘤
(1)10mg,(2)20mg,(3)30mg。
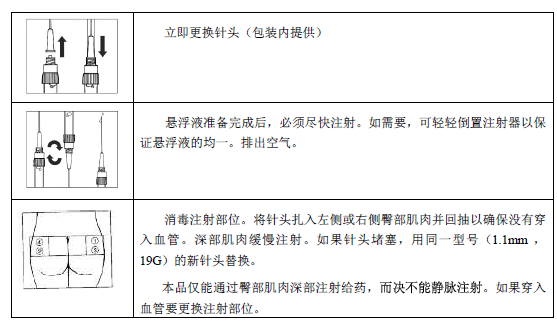
本品仅能通过臀部肌肉深部注射给药。重复注射应轮流选择左、右臀部肌肉。
本品肌肉注射的使用方法指导
仅用于臀部肌肉深部注射。

仅在马上要注射前准备,须由有经验的医务人员严格按下列指导操作。
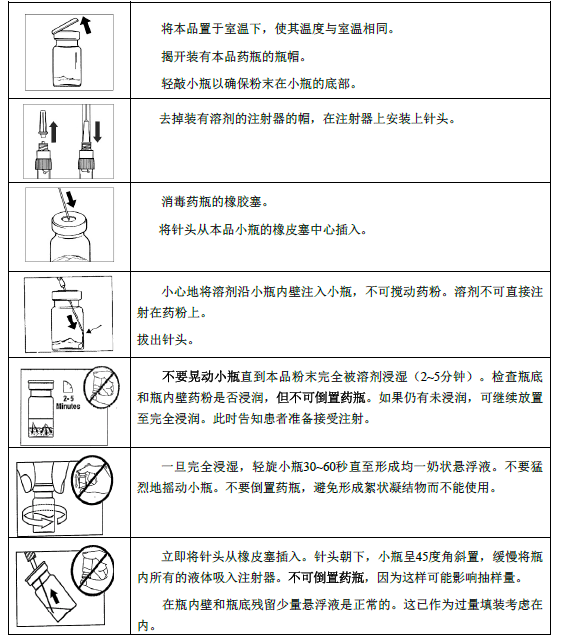
肢端肥大症
对使用标准剂量皮下注射善宁已完全控制的患者,本品的推荐初始剂量为20毫克,每4周给药一次,共3月。治疗可以在最后一次皮下注射善宁后一天开始。此后剂量应当根据血清GH和胰岛素生长因子-1(IGF-1)的水平以及临床症状和体征决定。
如果3月后临床症状和体征以及生化参数(GH和IGF-1)尚未完全控制(GH>2.5μg/L)时,剂量应当增至30毫克,每4周给药一次。如GH2.5μg/L,则继续使用20毫克治疗,每4周给药一次。
如果使用20mg治疗3月后,GH的浓度持续低于1μg/L,IGF-1的浓度正常以及临床上肢端肥大症的可逆的症状和体征消失,本品的剂量可降至10毫克。鉴于如此低的剂量,要密切观察监测血清GH和IGF-1的浓度以及临床症状和体征。
持续使用本品而未改变剂量的患者,应每6个月评价GH和IGF-1。
对于不适合外科手术、放疗或治疗无效的患者,或在放疗发挥充分疗效前病情处于潜在反应阶段的患者,建议在开始上述使用本品治疗前,先短期使用皮下注射善宁以评估奥曲肽治疗的耐受性和疗效。
胃肠胰内分泌肿瘤
已使用皮下注射善宁治疗的患者:对于皮下注射善宁能够控制症状的患者,建议本品的初始剂量为20毫克,每4周给药一次。应继续维持原有皮下注射善宁的有效剂量治疗至第一次注射本品后至少2周(有的患者则需维持3~4周)。
从未使用皮下注射善宁治疗的患者:建议开始使用本品治疗前,应短期(约2周)每日3次皮下注射善宁0.1毫克,以评估奥曲肽治疗反应和全身耐受性。
剂量调整
使用本品治疗3个月后,对于症状和生化指标已完全控制的患者,本品剂量可以降至10毫克,每4周给药一次。
使用本品治疗3个月症状仅部分控制的患者,剂量可以增至30毫克,每4周给药一次。
使用本品治疗胃肠胰肿瘤期间,患者的症状会一度更明显。此时建议加用皮下注射善宁,其剂量与使用本品之前相同。这对于治疗的最初2月使血奥曲肽达到治疗水平尤为重要。
肾功能损害患者的使用
当皮下注射善宁®治疗时,肾功能损害不会影响血奥曲肽的曲线下面积(AUC)。因此本品的剂量不必调整。
肝功能损害患者的使用
通过皮下和静脉途径给予善宁的研究发现肝硬化患者的清除力可能下降,而脂肪肝患者则不然。鉴于奥曲肽较宽的治疗窗,肝硬化患者的本品的剂量不需调整。
安全性特征总结
应用奥曲肽治疗时最常见的不良反应为胃肠道异常、神经系统异常、肝胆异常以及代谢和营养异常。
本品临床试验中报道的最常见的不良反应为腹泻、腹痛、恶心、胃肠胀气、头痛、胆结石、高血糖及便秘。其他经常报告的不良反应包括为眩晕、局部疼痛、胆汁郁积、甲状腺功能不全(例如,促甲状腺激素(TSH)降低、总 T4 降低以及游离 T4 降低)、稀便、糖耐量减低、呕吐、乏力、以及低血糖。
表 1 中列出了曾经在奥曲肽临床研究中报告的不良反应。
临床试验报告的药物不良反应列表总结
依照 MedDRA 系统器官分类对临床试验中报告的药物不良反应进行列表(表 1)。在每个系统器官分类中,药物不良反应按发生率降序排列,发生率最高的反应列于第一项。此外,每个药物不良反应的频率分类依照以下惯例(CIOMS III)进行:非常常见(≥ 1/10)、常见 (≥ 1/100, <1>表 1 临床研究中报告的药物不良反应

来源于自发性报告和文献案例的不良反应报告
以下不良反应均来自上市后使用中的自发性报告和文献案例报告。因为这些反应是来自规模不确定的人群中的自发报告,不能以此为依据确定发生率或建立与药物暴露的因果关系。依照 MedDRA 系统器官分类将不良反应进行列表。在每个系统器官分类中,药物不良反应按发生率降序排列。
表2 自发性报告的药物不良反应

已有不良反应的描述
胃肠功能紊乱和营养
在罕见的情况下,可能出现类似急性肠梗阻的胃肠副作用,伴进行性腹胀、严重的上腹痛、腹部压痛和板状腹。虽然大便脂肪排出量可能增加,但目前无资料证实长期使用奥曲肽治疗会由于吸收不良而导致营养缺乏。
胆囊及相关反应
生长抑制素类似物已被证明能抑制胆囊收缩并减少胆汁的分泌,这可能导致胆囊异常或有沉淀。已报道长期皮下注射善宁治疗的患者中有 15-30%的患者有胆石形成。一般人群(40 岁-60岁)中的发病率约为 5-20%。长期使用本品治疗的肢端肥大症或胃肠胰肿瘤患者的资料显示,与皮下注射的患者相比,使用本品治疗没有增加胆石发生率。治疗期间发生的胆囊结石通常是无症状的;有症状的结石症应当使用胆汁酸溶石治疗或手术治疗。
胰腺炎
有报道长期皮下注射善龙治疗的患者会因胆石症而导致胰腺炎的发生。有报道极少数患者在接受皮下注射善龙治疗后的最初几小时或几天内发生急性胰腺炎,在停药后消失。
心脏疾病
心动过缓是一种使用生长抑素类似物常见的不良反应。在肢端肥大症及类癌患者中观察到了心电图变化,例如 QT 间期延长、电轴偏移、早期复极、低电压、R/S 转换、早期 R 波递增和非特异性 ST-T 波改变。由于许多存在此类问题的患者用药之前就患有心脏疾病,因此尚未确定这些事件与奥曲肽之间的关联性(参见注意事项)。
超敏和过敏反应
上市后已有关于超敏反应和过敏反应的报道。这些反应主要影响皮肤,很少影响口腔和呼吸道。有个别过敏性休克的报道。
注射部位反应
注射部位的反应包括疼痛、发红、出血、瘙痒、肿胀或硬化,这些不良反应已经在接受善龙治疗的病人中有所报道。然而这些事件中的大部分并不需要进行临床干预。
血小板减少症
血小板减少症在上市后曾被报道,尤其在接受善宁/善龙治疗的肝硬化患者中。该不良反应在停止本品治疗后可逆。
对于奥曲肽或制剂中任何成分过敏者。
一般
由于分泌GH的垂体瘤有增大的可能,从而导致严重的并发症(如视野受限),因此要密切监察所有的患者,一旦发现有肿瘤增大的证据,建议改用其它的治疗方法。
生长激素(GH)水平的降低和胰岛素样生长因子 1(IGF-1)浓度恢复正常可能会恢复女性肢端肥大症患者的生育能力。如果必须使用奥曲肽治疗,那么治疗期间育龄期妇女需采取适当的避孕措施(参见【孕妇及哺乳期妇女用药】)。
使用奥曲肽长期治疗的患者需对甲状腺功能进行监测。
心血管相关事件
已报道有心动过缓的少见病例。可能需要调整β受体阻断剂、钙通道阻断剂药物的剂量,或调整水和电解质平衡。
胆囊和相关事件
使用善龙治疗中常见的不良反应是胆结石,胆结石的发生也可能与胆囊炎和胆道扩张有关(见第 7 节不良反应)。仍建议在使用本品治疗前和治疗后约每隔 6 个月进行胆囊超声检查。
糖代谢
由于对生长激素、胰高血糖素和胰岛素的释放具有抑制作用,善龙 ®可能影响葡萄糖的调节。餐后葡萄糖耐量可能受损。有报道使用皮下注射善宁 ®治疗的患者,在某些情况下,长期给药可能导致持续高血糖的情况。也有发生低血糖的报道。
对于胰岛素依赖的I型糖尿病患者,本品可能影响机体对血糖的调节功能,所需胰岛素治疗量可能会有所降低。皮下注射善宁治疗,对于非糖尿病患者和有部分胰岛素受损的II型糖尿病患者,可能导致餐后血糖升高,因此建议注意监测糖耐量以及相应降糖治疗。
胰岛素瘤患者:由于奥曲肽抑制生长激素和胰高糖素的作用强于对胰岛素的抑制,且对胰岛素的抑制时间较短,因此奥曲肽有可能加重并延长低血糖的发作。应密切观察此类患者。
营养
某些患者中,奥曲肽可能改变膳食脂肪的吸收。
在某些接受奥曲肽治疗的患者中已观察到维生素B12水平下降和Schilling’s检验异常。对于维生素B12缺乏的患者,在使用本品治疗期间,建议注意监测维生素B12水平。
其他事项
配伍禁忌
本品微球剂型仅能单剂使用,而不能用其他物质稀释或混合。因此没有与其他溶液和物质的配伍数据记录。
远离儿童视线,避免儿童误取。
妊娠
尚未在孕妇中进行充分且良好对照的临床研究。上市后,肢端肥大症患者中妊娠且接受奥曲肽治疗的报告数量有限,而且有一半病例的妊娠结果未知。大多数患者在妊娠早期接受奥曲肽治疗,剂量范围为每天 100 至 300µg 的善宁 ®皮下注射,或每月 20 至 30mg 的善龙 ®肌肉注射。这些妊娠病例中大约 2/3 的结局为已知,这些女性选择在妊娠期间继续接受奥曲肽治疗。已知大多数病例报告分娩了正常的新生儿,但是也有一部分病例报告在妊娠早期发生自然流产,还有一部分报告了人工流产。
在结局已知的妊娠病例中,没有出现因为应用奥曲肽而导致先天异常或畸形的病例。
除生理发育的一些暂时性滞后外,动物研究未提示对妊娠、胚胎/胎儿发育、分娩或产后发育具有直接或间接的有害影响。
哺乳
目前尚不清楚奥曲肽是否从人类乳汁中分泌。动物研究显示本品从乳汁分泌。使用善龙 ®治疗期间,妇女应该禁止哺乳。
目前尚无儿童使用本品的经验。
皮下注射善宁®的研究发现,65岁以上的患者的剂量不需要调整。因此这些患者也不须调整本品的剂量。
已发现奥曲肽可降低肠道对环孢素的吸收,也可减慢对西咪替丁的吸收。
同时使用奥曲肽及溴隐亭,可以增加溴隐亭的生物利用度。
少数发表的数据显示,生长抑素类似物由于对生长激素的抑制作用可能减慢通过细胞色素P450酶代谢的物质的清除。虽然尚不能断言奥曲肽具有这样的作用,但对同时使用主要通过CYP3A4代谢且治疗指数窄的药物,如奎尼丁和特非那定等时,应特别注意。
已经收到关于本品意外用药过量的数量有限的报告。本品每月剂量范围为 100mg 至 163mg。报告的唯一不良反应是面部潮红。
有报告称,癌症患者使用本品剂量达 60mg/每月及 90mg/每 2 周。这些剂量通常耐受性良好,但是曾经报告了以下不良反应:尿频、乏力、抑郁、焦虑、注意力不集中。
如发现药物过量,须进行对症治疗。
一项 III 期、随机、双盲、安慰剂对照研究(PROMID)证实,本品抑制了中肠晚期神经内分泌肿瘤患者的肿瘤生长。
85 名患者随机接受了本品 30mg(n=42)或安慰剂(n=42)的治疗,每 4 周给药一次,共治疗 18 个月,治疗至出现肿瘤进展或死亡。
入组本研究的患者须满足以下主要纳入标准:未曾治疗的患者;经组织病理学证实;局部不能手术切除或转移性的高分化肿瘤;功能活跃或不活跃的神经内分泌肿瘤/癌;原发肿瘤病灶位于中肠或原发不明但支持起源于中肠,排除原发病灶位于胰腺、胸部或其他部位者。
主要终点是至肿瘤进展或至肿瘤相关性死亡时间(TTP),采用 WHO 标准进行中心影像片审阅。
善龙 ®组在 TTP 上优于安慰剂,善龙 ®组和安慰剂组分别发生了 26 例和 38 例进展或肿瘤相关性死亡(HR=0.36;95%CI,0.21 至 0.61;p 值=0.0001)(参见图 1)。
善龙 ®组中位至肿瘤进展时间为 14.3 个月(95% CI,11.0 至 28.8 个月),安慰剂组为 5.9 个月(95% CI,3.7 到 9.2 个月)。
图 1 各治疗组至肿瘤进展时间的 Kaplan-Meier 曲线(全分析集)
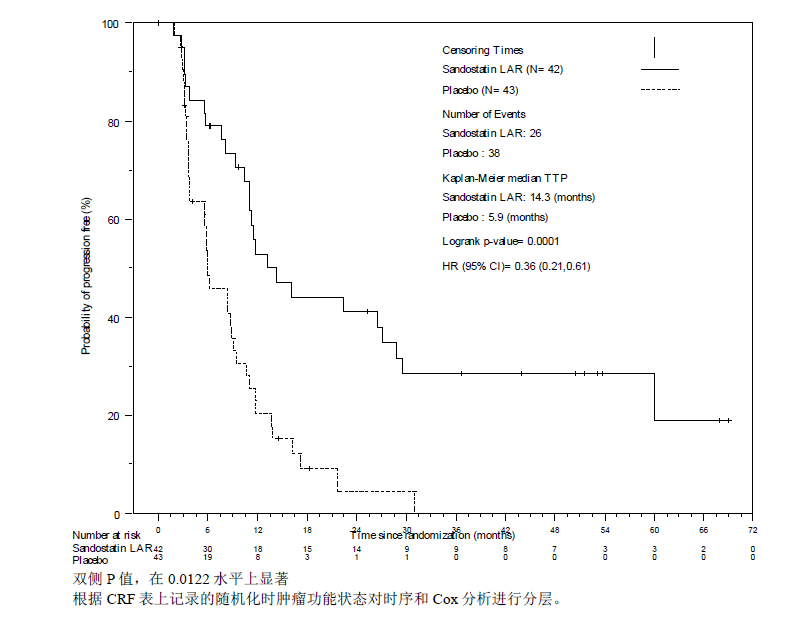
功能性肿瘤患者(HR=0.41;95%CI,0.18 至 0.92)和非功能性肿瘤患者(HR=0.32;95%CI, 0.15 至 0.66)中的疗效相似。
根据预先计划的中期分析所观察到善龙 ®组的显著临床获益,研究停止了患者入组。
在后续 4.5 年的随访后,善龙 ®对比安慰剂在总生存方面的风险比为 0.86(95% CI:0.46,1.60),提示善龙 ®治疗有生存优势。但由于事件数量少,并且大部分安慰剂组患者选择接受生长抑素类似物随访治疗,因此应谨慎解释总生存的结果。
本品在该试验中的安全性与已确立的安全性特征相一致。
奥曲肽是一种人工合成的天然生长抑素的八肽衍生物,它保留了与生长抑素相同的药理作用,但作用持久。它能抑制生长激素(GH)以及胃肠胰(GEP)内分泌系统产生的多肽和血清素的病理性分泌增加。
在动物体内,奥曲肽较生长抑素有更强的抑制生长激素、胰高糖素和胰岛素释放的作用,以及对GH和胰高糖素有更强的选择性。
健康受试者的研究表明,奥曲肽与生长抑素相似,它可以抑制:
--由精氨酸、运动或胰岛素导致的低血糖引起的生长激素释放。
--餐后的胰岛素、胰高糖素、胃泌素以及GEP系统其他肽类的分泌,以及由精氨酸导致的胰岛素和胰高糖素的分泌。
--由促甲状腺激素释放激素(TRH)刺激引起的促甲状腺素(TSH)的释放。
与生长抑素不同,奥曲肽抑制GH的作用优于对胰岛素的抑制,且给药后不会伴有激素反弹性的分泌增加(例如肢端肥大患者中的GH)。
对于肢端肥大症患者,本品—注射用长效奥曲肽微球—适合每4周重复给药,能够持续产生有治疗作用的血清奥曲肽水平,从而保持持续地降低GH的水平并使血清IGF-1正常。在多数患者,本品能明显改善他们的临床症状,例如头痛、多汗、感觉障碍、疲劳、关节痛以及腕管综合症。已有报道,在给予本品后,少数GH分泌性垂体腺瘤患者的瘤体缩小。
胃肠胰内分泌系统功能性肿瘤的患者使用本品后能够持续控制原有疾病的相关症状。奥曲肽对不同类型的胃胰肠内分泌肿瘤的治疗作用如下:
—类癌
奥曲肽能改善症状,特别是潮红和腹泻,并使某些患者的血浆血清素水平下降和尿中5-羟吲哚乙酸的分泌量减少。
—血管活性肠肽瘤
该类肿瘤最主要的生化特征是过量产生血管活性肠肽(VIP),它的临床特征是严重的分泌性腹泻。对于大多数患者,奥曲肽能缓解腹泻,从而提高患者的生活质量。奥曲肽也可改善相应的电解质紊乱(例如低血钾),从而可暂停胃肠内外电解质的补充治疗。计算机断层扫描提示:有些患者用药后肿瘤生长延缓或停滞,甚至缩小,尤其是伴有肝转移的患者。临床症状的改善也伴有血浆VIP水平的降低甚至正常。
—胰高糖素瘤
大多数使用奥曲肽的患者可以使该病特征性的坏死游走性皮疹有所改善,而对此类患者易并发的轻度糖尿病几乎没有影响。因此,胰岛素和口服降糖药的剂量通常不需减少。奥曲肽的治疗可使已存在的腹泻有所好转,而使患者体重增加。奥曲肽通常可使血浆胰高糖素的水平迅速降低,虽然可持续改善临床症状,但这一作用并不持久。
—胃泌素瘤/卓-艾综合征
对因慢性胃泌素刺激所导致的胃酸分泌过多引起的反复发作的消化性溃疡,选择性H2受体拮抗剂和抗酸剂治疗并非全部有效,而且某些明显的腹泻症状很少缓解。对于此类患者,单独使用奥曲肽或与H2受体拮抗剂联合使用,能降低半数以上的患者胃酸的过多分泌,并改善临床症状(包括腹泻)。并能缓解其它可能由肿瘤分泌的肽所导致的症状(如潮红)。奥曲肽可使某些患者的血浆胃泌素水平降低。
—胰岛素瘤
奥曲肽可使血液循环中免疫反应性胰岛素水平降低。对于可手术切除肿瘤患者,术前使用奥曲肽有助于恢复和维持正常血糖。对于不能手术切除的良、恶性肿瘤患者,奥曲肽可改善血糖的调节,即使循环中胰岛素水平不能持续下降。
—生长激素释放因子腺瘤
这是一种能单纯产生生长激素释放因子(GFR)或同时分泌其它具有生物活性肽的罕见肿瘤。两例病人中的一例由于本品的治疗而改善了肢端肥大症的临床症状。此作用可能是因抑制GFR和GH的分泌而产生的。它可能使增大的垂体缩小。
单次肌内注射本品后,血清中奥曲肽浓度在给药后1小时内迅速达到第一次峰值,随后24小时内奥曲肽水平逐渐下降至不可测得的低水平。在第一天达到峰值随后的7天,多数患者的奥曲肽保持在治疗水平之下。此后,奥曲肽血浓度再次升高并于第14天左右达到平台,并于此后的3-4周内保持相对稳定。
第一天的峰值水平较平台期水平低。在第一天药物释放量不到总药量的0.5%。约在第42天后,奥曲肽的浓度伴随多聚体基质的终末降解相而缓慢下降。
肢端肥大症的患者,给予单剂10、20及30毫克本品后,奥曲肽的平台浓度分别可达358ng/L、926ng/L及1710ng/L。以4周为间隔注射3次后,达到的稳态血浆奥曲肽浓度约高1.6-1.8倍,多次注射本品 20及30毫克后则分别达到1557ng/L及2384ng/L。
类癌患者以4周为间隔多次注射本品 10、20及30毫克后,血浆奥曲肽的平均(中位)稳态浓度随剂量呈线性增加,分别为1231(894)ng/L、2620(2270)ng/L以及3928(3010)ng/L。
每月注射本品达28月后,奥曲肽的蓄积并未象期望的那样的超过重叠释放水平。
注射本品后,奥曲肽的药代动力学反映了它从多聚体基质中释放的特性和生物降解物。一旦释放进入全身循环,奥曲肽的分布与已知的皮下注射给药的药代动力学特点一致。稳定状态时奥曲肽的分布容积为0.27L/Kg,总体清除率为160毫升/分。血浆蛋白结合率65%,与血细胞结合的奥曲肽可忽略不计。
为延长贮存期,本品小瓶应当保存在2-8℃的冰箱内并避免冷冻和光照。注射前约24小时,本品应放置在25℃以下。配制后的本品溶液应当立即使用。
玻璃瓶,橡胶塞。
1瓶/盒(内附2个针头和1支预充式注射器,内含2.5ml溶剂)。
36个月
JX20050124
进口药品注册证号
10mg:H20150248
20mg:H20150247
30mg:H20150246
FDA妊娠分级:B