

注射用盐酸表柔比星
艾达生
Epirubicin Hydrochloride for Injection
Zhu She Yong Yan Suan Biao Rou Bi Xing
化学名称:本品的主要成分为盐酸表柔比星,化学名为(7S:9S)-9-羟乙酰基-4-甲氧基-7,8,9,10-四氢-6,7,9,11-四羟基-7-O-(2,3,6-三去氧-3-氨基-α-L-阿拉伯吡喃糖基)-5,12-萘二酮盐酸盐。
化学结构式:
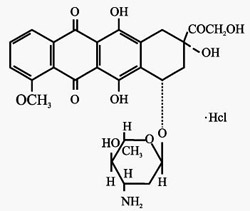
分子式:C27H29NO11·HCL
分子量:579.98
辅料:乳糖
本品为鲜红色或橙红色冻干块状物;有引湿性。
用于治疗白血病,恶性淋巴瘤,多发性骨髓瘤,乳腺癌 、肺癌 、软组织肉瘤、胃癌 、肝癌、结肠直肠癌、卵巢癌等。
10mg
表柔比星单独用药时,成人剂量为按体表面积一次60~90mg/m2,联合化疗时,每次50~60mg/m2静脉注射。根据病人血象可间隔21天重复使用。
1.与阿霉素相似,但程度较低,尤其是心脏毒性和骨髓抑制毒性;
2.其它不良反应有:脱发,60~90%的病例可发生,一般可逆,男性有胡须生长受抑;粘膜炎,用药的第5~10天出现,通常发生在舌侧及舌下粘膜;胃肠功能紊乱,如恶心、呕吐、腹泻;曾有报道偶有发热、寒颤、荨麻疹、色素沉着、关节疼痛。
1.禁用于因用化疗或放疗而造成明显骨髓抑制的病人;
2.已用过大剂量蒽环类药物(如阿霉素或柔红霉素)的病人;
3.近期或既往有心脏受损病史的病人。
1.关于心脏毒性
(1)可导致心肌损伤,心力衰竭。动物实验和短期人体实验表明,表柔比星的心脏毒性比它的同分异构体阿霉素小。比较性研究表明,表柔比星和阿霉素引起相同程度心功能减退的蓄积剂量之比为2:1。在表柔比星治疗期间仍应严密监测心功能,以减少发生心力衰竭的危险(这种心力衰竭甚至可以在终止治疗几周后发生,并可能对相应的药物治疗无效);
(2)对目前或既往接受纵隔、心包区合并放疗的病人,表柔比星心脏毒性的潜在危险可能增加;
(3)在确定表柔比星最大蓄积剂量时,与任何具有潜在心脏毒性药物联合用药时应慎重;
(4)在每个疗程前后都应进行心电图检查。蒽环类,尤其是阿霉素所引起的心肌病,在心电图上表现为QRS波群持续性低电压、收缩间期的延长超过正常范围(PEP/LVET),以及射血分数减低。对接受表柔比星治疗的病人,心电监护是非常重要的,可以通过无创伤性的技术如心电图、超声心动图来评估心脏功能。如有必要,可通过放射性核素血管造影术测量射血分数。
2.关于肝肾功能影响
(1)由于表柔比星经肝脏系统排泄,故肝功能不全者应减量,以免蓄积中毒。中度肝功能受损者(胆红素1.4~3mg/100ml或BSP滞留量9~15%),药量应减少50%。重度肝功能受损者(胆红素大于3mg/100ml或BSP滞留量大于15%)药量应减少75%;
(2)中度肾功能受损患者无需减少剂量,因为仅少量的药物经肾脏排出。表柔比星和其它细胞毒药物一样,因肿瘤细胞的迅速崩解而引起高尿酸血症。应检查血尿酸水平,通过药物控制此现象的发生;另外,在用药1~2天内可出现尿液红染;
3.关于骨髓抑制
可引起白细胞及血小板减少,应定期进行血液学监测。
4.关于给药说明
(1)静脉给药,用灭菌注射用水稀释,使其终浓度不超过2mg/ml。
(2)建议先注入生理盐水检查输液管通畅性及注射针头确实在静脉之后,再经此通畅的输液管给药。以此减少药物外溢的危险,并确保给药后静脉用盐水冲洗。
(3)表阿霉素注射时溢出静脉会造成组织的严重损伤甚至坏死。小静脉注射或反复注射同一血管会造成静脉硬化。建议以中心静脉输注较好。
(4)不可肌肉注射和鞘内注射。
尚无定论性资料说明表柔比星对人的生育力是否有不利影响,以及对胎儿是否有致畸作用或其它有害影响。但有实验资料提示表柔比星与大多数抗肿瘤药物和免疫抑制剂类似,在特定试验条件下,在动物身上表现出致突变性和致癌性,可以降低胎儿的成活率。因此在妊娠期间不主张使用本品,哺乳期妇女禁用。
儿童用药无特殊要求。
老年患者伴心功能减退者宜慎用或减量。
1.表柔比星可与其他抗肿瘤药物合用,但表柔比星用量应减低。联合用药时,不得在同一注射器内使用。
2.表柔比星不可与肝素混合注射,因为二者化学性质不配伍,在一定浓度时会发生沉淀反应。
本品总限量为按体表面积550~800mg/m2
以上主要来自国外临床研究资料
两项随机、开放、多中心临床研究评估了表柔比星100~120mg/m2 联合环磷酰胺与氟脲嘧啶,辅助治疗腋下淋巴阳性不伴远处转移的乳腺癌患者(II或III期)。MA-5研究对表柔比星每个疗程120mg/m2联合环磷酰胺与氟脲嘧啶(CEF-120)方案进行了评估,该研究将伴有1个或以上淋巴结转移的绝经前和围绝经期女性患者随机分为含有表柔比星的CEF-120组或CMF组。GFEA-05研究则评估了表柔比星每个疗程100mg/m2联合氟脲嘧啶与环磷酰胺(FEC-100方案),将绝经前和绝经后女性患者随机分为FEC-100组或较低剂量的FEC-50组。GFEA-05研究入组患者要求伴有4个或以上淋巴结阳性,或,如果阳性淋巴结为1-3个,则要求患者雌激素和孕酮受体为阴性,而且肿瘤组织学为3级或2级。这两项研究共入选1281名妇女,肿瘤组织学4级的患者均未入选。
表1列出各治疗方案,试验的主要终点指标为无复发生存时间(包括发生局部或区域复发、远处转移或疾病相关性死亡的时间)。最后一次随访时记录是否发生对侧乳腺癌、患第二种原发性肿瘤或非乳腺癌导致的死亡。
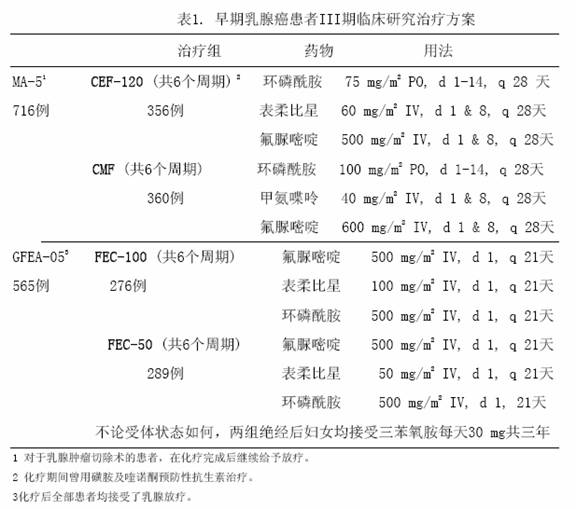
MA-5研究中,患者中位年龄45岁,肿瘤淋巴结转移1-3个占60%,4个或以上占40%。GFEA-05研究中,中位年龄51岁,近半数为绝经后患者,肿瘤淋巴结转移1-3个占17%,4个或以上占80%。每项研究两组的人口统计学及肿瘤特征均相近。
两项研究的疗效学指标为意向性治疗(ITT)患者的无复发生存(RFS)及总体生存(OS),采用Kaplan-Meier方法分析。随访5年时进行了首次分析,结果见表2及下文,随访10年的分析结果列于表2。MA-5研究中,含有表柔比星的联合治疗方案(CEF-120)无复发生存率显著高于CMF方案(5年无复发生存率分别为62%和53%,logrank分层分析 p=0.013),5年复发风险降低24%。表柔比星为主联合治疗方案(CEF-120)的总体生存率也高于CMF(5年总生存率分别为77%和70%,logrank 分层分析 p=0.043;logrank未分层分析p=0.13)。5年的死亡风险降低29%。在GFEA-05研究,高剂量表柔比星治疗(FEC-100)患者5年无复发生存率和总体生存率均显著高于低剂量组(FEC-50),两组5年无复发生存率分别为65%和52%(logrank检验p=0.007),总体生存率分别为76%和65%(logrank 检验 p=0.007),5年的复发风险降低32%,死亡风险降低31%。MA-5和GFEA-0510年随访(中位随访时间分别为8.8年和8.3年)的结果见表2。虽然没有设定亚组分析,但是在MA-5研究中,伴有1-3个淋巴结转移和4个及以上淋巴结转移的患者中,CEF-120方案治疗的无复发生存率和总体生存率均优于CMF。在GFEA-05研究中,绝经前和绝经后患者接受FEC-100方案治疗的无复发生存率和总体生存率也均优于接受FEC-50方案治疗者。

MA-5研究无复发生存率和总体生存率的Kaplan-Meier曲线见图1和图2,GFEA-05研究无复发生存率和总体生存率的Kaplan-Meier曲线见图3和图4
图 1.MA-5研究无复发生存率曲线
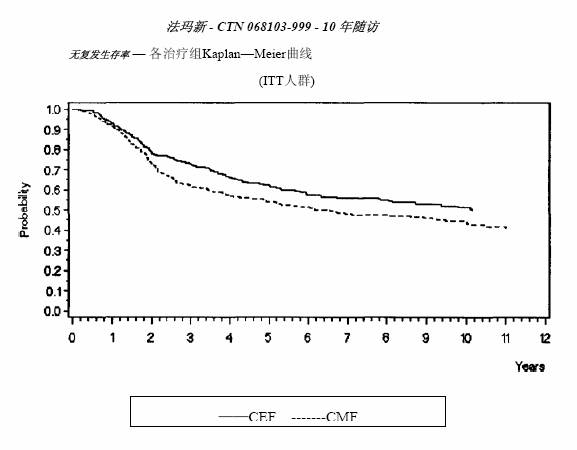
图 2.MA-5研究总体生存率曲线
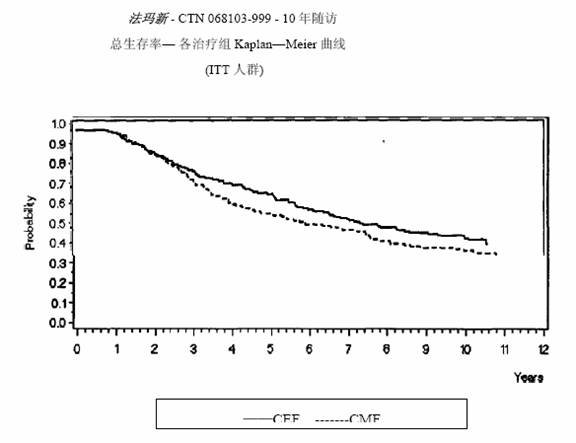
图 3.GFEA-05研究无复发生存率曲线

图 4.GFEA-05研究总体生存率曲线
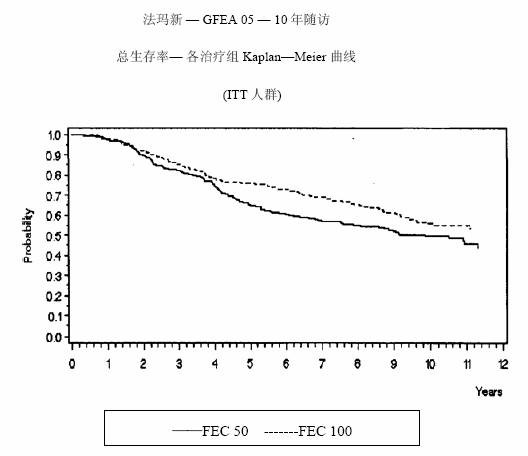
5年和10年数据的统计分析见表2
4'位置上的羟基由顺位变为反位。为一细胞周期非特异性药物,其主要作用部位是细胞核。本品的作用机制与其能与DNA结合有关。体外培养的细胞加入本品可迅速透入胞内,进入细胞核与DNA结合,从而抑制核酸的合成和有丝分裂。已证实表阿霉素具有广谱的抗实验性肿瘤的作用,对拓扑异构酶也有抑制作用。疗效与阿霉素相等或略高,而毒性尤其是心脏毒性低于阿霉素。
体内代谢和排泄较阿霉素快,平均血浆半衰期约40小时,主要在肝脏代谢,经胆汁排泄。48小时内,9~10%的给药量由尿排出,4天内,40%的给药量由胆汁排出,该药不通过血脑屏障。对有肝转移和肝功能受损的病人,该药在血浆中的浓度维持时间较长,故应适当减小剂量。肾功能正常与否对本品的药代动力学特性影响不大。
密闭,在凉暗干燥处(避光不超过20℃)保存。
抗生素玻璃瓶、纸盒,1瓶/盒。
24个月。
YBH03762011
国药准字H19990280
FDA妊娠分级:D