

来曲唑片
弗隆 Femara
Letrozole Tablets
Lai Qu Zuo Pian
请仔细阅读说明书并在医师指导下使用。
运动员慎用
本品活性成份为来曲唑。
化学名称:4,4'[(1H-1,2,4-三唑-1-基)-亚甲基]-双-苄腈
化学结构式:

分子式:C17H11N5
分子量:285.3
本品为薄膜包衣片,除去包衣以后显白色。
对绝经后早期乳腺癌患者的辅助治疗,此类患者雌激素或孕激素受体阳性。
对已经接受他莫昔芬辅助治疗5年的、绝经后早期乳腺癌患者的辅助治疗,此类患者雌激素或孕激素受体阳性。
治疗绝经后、雌激素受体阳性、孕激素受体阳性或受体状况不明的晚期乳腺癌患者,这些患者应为自然绝经或人工诱导绝经。
2.5mg
本品的推荐剂量为2.5mg,每日一次。
以本品作为辅助治疗时,应服用5年或直到病情复发(以先发生为准)。在来曲唑对比他莫昔芬作为辅助治疗的大型关键研究中发现,这两种药物序贯给药与来曲唑持续用药5年相比,疗效或安全性方面并无优势。
对于已经接受他莫昔芬辅助治疗5年的患者,应连续服用本品直到病情复发。对于转移性疾病患者,本品的治疗应持续到证实肿瘤出现进展时为止。
本品应口服,饭前饭后皆可,因为食物对其吸收程度没有影响。
如果漏服,患者记起时应立即补服。但是如果已经几乎到了下一次服药时间,则应跳过这次漏服的剂量,按规则的服药时间表服药。剂量不得加倍,因为在日剂量超过2.5 mg推荐剂量时,观察到全身暴露超过剂量比例(参见【药代动力学】)。
特殊人群
肝功能受损
对于轻到中度肝功能受损(Child-Pugh评分A或B)的患者,无需调整剂量。重度肝功能受损(Child-Pugh评分C)患者的数据不充分,但这些患者如需使用,应在密切监测下用药(参见【注意事项】及【药代动力学】)。
肾功能受损
对于肾功能受损但肌酐清除率CLcr≥10ml/min的患者,无需调整剂量。肾功能受损且CLcr<10ml>
安全性特征总结
本品在所有接受一线治疗和二线治疗的晚期乳腺癌患者中,以及接受辅助治疗和接受他莫昔芬标准辅助治疗后接受后续强化辅助治疗的早期乳腺癌患者中均显示良好的安全性。约81%接受辅助治疗的患者(本品和他莫昔芬对照组),87-88%序贯治疗组患者,中位治疗持续时间60个月;80%接受后续强化辅助治疗的患者(本品和安慰剂对照组,中位治疗持续时间60个月)和三分之一接受本品治疗的晚期转移以及新辅助治疗患者均发生不良反应。临床研究中观察到的不良反应为轻度到中度,并且许多不良反应与雌激素剥夺相关。
临床试验中最常见的不良反应为潮热,关节痛、恶心和疲劳。很多不良反应是因为雌激素剥夺所致的正常药理作用(如,潮热、脱发和阴道出血)。表1列出的不良反应来源于临床研究和上市后报告。
表1 列表总结了临床试验中和上市后报告中使用本品的不良反应
不良反应按照发生的频率分类,首先是最常发生的, 使用以下习惯表达 :很常见:≥10%;常见:≥1%,<10%;不常见:≥0.1%,<1%;少见:≥0.01%,<0.1%;罕见:<0.01%;未知(根据已获得的数据无法估计)。

1仅在治疗转移性疾病时报告了这一药物不良反应。
2 根据FACE研究数据确定频率
3 在一些病例中,跌倒报告为其他不良事件的结果,如头晕和眩晕
选择的药物不良反应的描述
心脏不良反应
在作为辅助治疗时,除了表6所列的数据之外,本品和他莫昔芬(中位治疗持续时间5年)还分别报告了以下不良事件:需要手术治疗的心绞痛(1.0%对比1.0%);心衰(1.1%对比0.6%);高血压(5.6%对比5.7%);脑血管意外/短暂性脑缺血发作(2.1%对比1.9%)。
在作为后续强化辅助治疗时,本品(中位治疗持续时间5年)和安慰剂(中位治疗持续时间3年)分别报告:需要手术治疗的心绞痛(0.8%对比0.6%);新发或恶化的心绞痛(1.4%对比1.0%);心肌梗塞(1.0%对比0.7%);血栓栓塞事件*(0.9%对比0.3%);卒中/短暂性脑缺血发作*(1.5%对比0.8%)。
标有星号(*)的事件在两组之间的对比差异具有统计学显著性。
骨骼不良反应
作为辅助治疗时在骨骼方面的安全性数据见表6。
在作为后续强化辅助治疗时,本品治疗患者中出现骨折或骨质疏松症的患者比例(骨折10.4%,骨质疏松症12.2%)显著高于安慰剂组(分别为5.8%和6.4%)。来曲唑的中位治疗持续时间为5年,而安慰剂为3年。
对活性药物和/或任意一种赋形剂过敏的患者。
绝经前内分泌状态;妊娠期、哺乳期妇女(参见【孕妇及哺乳期妇女用药】及【药理毒理】)。
运动员慎用
月经状态
对于绝经状态不明的患者,在治疗之前须检查患者的LH、FSH和/或雌二醇水平从而确定其绝经状态。只有确认绝经后内分泌状态的女性才能接受本品治疗。
生育力
来曲唑的药理学作用是通过抑制芳香酶来降低雌激素的产生。在绝经前的女性中,抑制雌激素合成会导致促性腺激素(LH、FSH)水平升高。FSH升高会刺激卵泡生长,从而导致排卵。
药物相互作用
应避免本品与他莫昔芬、其它抗雌激素药物或含雌激素的药物同时使用,因为这些药物会抵消本品的药理作用。这一相互作用的机制尚不清楚(参见【药物相互作用】)。
骨骼影响
使用本品时,有骨质疏松症和/或骨折的报告。因此,建议在治疗期间监测全身骨骼健康(参见【不良反应】和【药理毒理】)。
肾功能受损
没有在肌酐清除率<10 ml>
肝功能受损
重度肝功能受损(Child-Pugh评分C)的患者中,其全身药物浓度和药物的终末半衰期接近健康志愿者的2倍,因此应对这些患者严密观察(参见【药代动力学】)。
对驾驶和操作机器能力的影响
在应用本品过程中可观察到用药相关的疲乏和头晕,偶见观察到嗜睡,因此应提醒患者当驾驶车辆或操作机器时应注意。
妊娠
风险总结
本品禁用于妊娠期女性(参见【禁忌】)。
妊娠期女性使用本品可能引起胎儿损害。如果妊娠期间使用本品或如果患者在使用本品时发生妊娠,则患者应获悉对胎儿的可能风险。
尚未对使用本品的妊娠期女性开展临床试验。但是上市后有在妊娠期间曾服用本品的母亲发生自然流产和婴儿先天畸形的报告(参见【注意事项】)。大鼠中的生殖毒性研究证实本品诱发了胚胎毒性和胎儿毒性以及致畸性。在大鼠和家兔中,使用本品剂量远小于以mg/m2计的最大推荐人体剂量(MHRD)造成了不良妊娠结果,包括先天畸形。观察到的作用包括植入后的怀孕损失和再吸收增加,活胎更少,以及影响肾脏和骨骼系统的胎儿畸形。
已有个案报道,妊娠期女性在超说明书适应症使用本品(不孕治疗、排卵诱导)后导致婴儿出生缺陷(阴唇融合、性器官不明)。
动物研究数据
在胚胎-胎崽发育研究中,怀孕大鼠在器官形成期间经口接受本品0.03 mg/kg/天。大鼠生殖研究显示,器官形成期间来曲唑剂量>0.003 mg/kg时发生胚胎毒性和胎崽毒性,该剂量等于或大于MHRD的1/100(以mg/m2计)。在剂量≥ 0.003 mg/kg时观察到的胚胎和胎崽毒性作用包括子宫内死亡、再吸收增加、植入后损失增加、活胎数量减少以及包括肾乳头缩短、输尿管扩张、水肿和骨骼变异的胎崽畸形。相当于MHRD的1/10(以mg/m2计)的0.03 mg/kg的来曲唑剂量能够产生畸形并导致胎崽圆顶头和颈部/中心椎骨融合。
在胚胎-胎崽发育研究中的怀孕家兔中,经口给药剂量>0.006 mg/kg/天的来曲唑与胚胎毒性和胎崽毒性的体征有关,症状表现为再吸收增加、植入后损失增加和活胎数量减少。没有致畸性证据。
哺乳
风险总结
本品禁用于哺乳期女性(参见【禁忌】)。
来曲唑是否能够分泌入人乳汁中尚不清楚。目前没有本品对母乳喂养的婴儿或对泌乳影响的相关数据。由于许多药物能够分泌到人乳汁中,并且本品存在导致母乳喂养婴儿不良反应的可能性,因此应告知哺乳期女性在哺乳期服药对孩子的潜在风险。应将哺乳对发育和健康的益处与母亲对本品的临床需求以及本品或潜在母体环境对母乳喂养孩子产生的任何潜在不良作用一起综合考虑。
动物研究数据
大鼠暴露于0.003 mg/kg/天的来曲唑与雄性后代的生殖性能受损有关。对雌性后代的生殖性能无影响。
有生育可能的女性和男性
避孕
对于有妊娠可能的女性,包括围绝经期或者绝经不久的女性,医师应告知这些患者充分避孕的必要性,直到患者完全达到绝经后状态。
应告知有生育可能的女性,人体数据和动物研究已显示本品对发育中的胎儿有害。有生育可能并有性行为的女性应在使用本品治疗期间以及停止使用本品治疗后持续20天(5 x T½)采取有效的避孕措施(妊娠率低于1%的方法)。
不孕
大鼠的生育力研究显示,来曲唑在相对于人的剂量时对雄性和雌性生育力有不良作用。哺乳期大鼠暴露于低达0.003 mg/kg/天的来曲唑时与雄性后代的生育力受损有关。对雌性后代的生育力无影响。
在幼鼠研究中,在所有剂量(最低剂量为0.003 mg/kg/天)下生育力下降均伴有脑垂体肥大和睾丸改变,包括输精管上皮退行性变和雌性大鼠生殖道萎缩。除雌性大鼠骨骼大小以及睾丸的形态学改变之外,其余所有影响至少是部分可逆的。根据动物研究,本品可能损害有生育可能的男性的生育力。
来曲唑不能应用于儿童或青少年。
老年患者无须调整剂量。
来曲唑主要通过肝脏代谢,由细胞色素P450酶CYP3A4和CYP2A6介导曲唑的代谢清除。因此,影响CYP3A4和CYP2A6的药物会影响来曲唑的全身消除。来曲唑与其代谢酶CYP3A4的亲和力较低,因为该酶在一般临床情况下来曲唑稳态血浆浓度的150倍以上时尚无法达到饱和。
可能会提高来曲唑血清浓度的药物
CYP3A4和CYP2A6抑制剂的作用会减少来曲唑的代谢,从而增加来曲唑的血浆浓度,合并给药这些酶的强抑制剂(CYP3A4强抑制剂:包括但不限于酮康唑,伊曲康唑,伏立康唑,利托那韦,克拉霉素和泰利霉素;CYP2A6(例如甲氧沙林))可能增加来曲唑的暴露。因此,对服用CYP3A4和CYP2A6强抑制剂的患者,应谨慎。
可能会降低来曲唑血清浓度的药物
CYP3A4和CYP2A6诱导剂的作用会增加来曲唑的代谢,从而降低来曲唑的血浆浓度,合并给药CYP3A4诱导剂(例如:苯妥英,利福平,卡马西平,苯巴比妥和圣约翰草)可能减少来曲唑的暴露。因此,对服用CYP3A4强诱导剂的患者,应谨慎。没有已知的CYP2A6的药物诱导剂。
本品(25mg)与他莫昔芬20mg每天一次同时给药导致来曲唑血浆浓度平均下降38%。本品作为乳腺癌二线治疗的临床试验表明,如果在他莫昔芬给药之后立即服用本品,即不会提高本品的治疗作用,也不会导致不良反应增多。这一相互作用的机制尚不清楚。
可能会被来曲唑改变全身血清浓度的药物
在体外试验中发现,来曲唑会抑制细胞色素P450同工酶CYP2A6,并且中度抑制CYP2C19,但其临床意义尚不清楚。因此,当来曲唑与主要依靠CYP2C19消除并且治疗窗较窄的药物(如苯妥英、氯吡格雷)同时使用时应该谨慎。尚不知治疗窗狭窄的CYP2A6底物。
本品与西咪替丁(CYP2C19和CYP3A4的己知非特定性抑制剂)和华法林(CYP2C19的敏感底物并且治疗窗狭窄,在来曲唑的目标人群中通常联合使用)的相互作用临床研究表明,本品与这些药物同时使用不会引起临床显著的药物相互作用。
临床试验数据库的审查结果表明,没有与其他常用处方药物发生其他临床相关的相互作用的证据。
曾有来曲唑过量的个案报道。目前尚不知道有特殊治疗,治疗应为全身性和支持性的。
以下临床试验资料主要来自国外进行的临床研究。
辅助治疗
研究BIG 1-98(CFEM345 0019)
研究BIG 1-98是一项在超过8000例绝经后受体阳性的早期乳腺癌患者中进行的多中心、随机、双盲研究,患者随机分组接受下列某一种治疗:A.他莫昔芬5年;B.来曲唑5年;C.他莫昔芬2年,随后接受来曲唑3年;D.来曲唑2年,随后接受他莫昔芬3年。
主要研究终点是无病生存期(DFS),次要研究终点是至远处转移的时间(TDM),无远处转移生存期(DDFS),总生存期(OS),无全身疾病生存期(SDFS),侵袭性对侧乳腺癌和乳腺癌复发的时间。
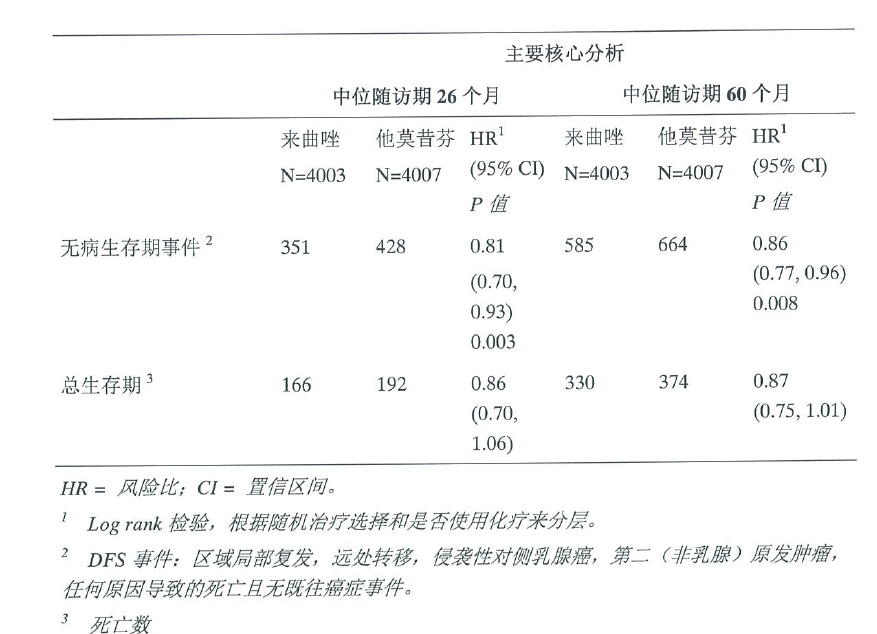
中位随访期26和60个月时的有效性结果
表2中的数据反映了主要核心分析结果,包括来单药治疗组(A组和B组)及两个换药组(C组和D组)在中位治疗持续时间24个月和中位随访期26个月,以及中位治疗持续时间32个月和中位随访期60个月的数据。
来曲唑组和他莫昔芬组的5年DFS率分别为84%和81.4%。
表2 主要核心分析:中位随访期26和60个月的无病生存和总生存期(ITT 人群)
中位随访期96个月时单药治疗组分析的有效性结果
来曲唑对比他莫昔芬(辅助治疗的中位持续时间为5年)的单药治疗组疗效分析(MAA)的长期更新见表3。
表3 单药治疗组分析:中位随访期96个月时的无病生存期和总生存期(ITT人群)
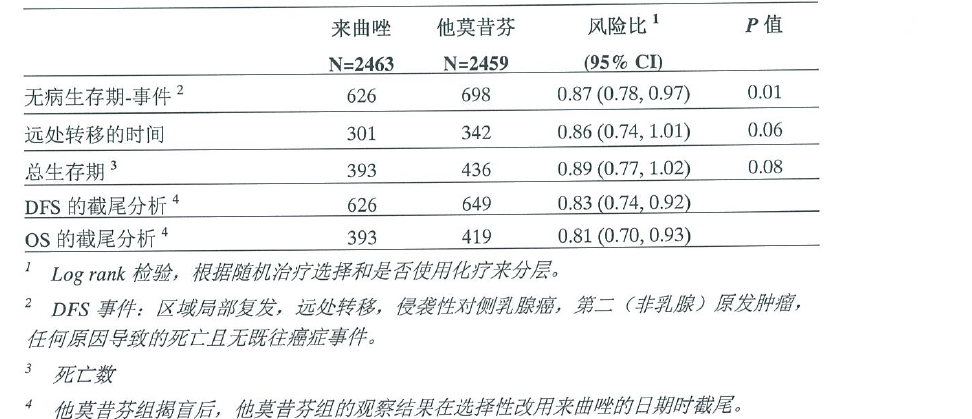
序贯治疗分析(STA)
序贯治疗分析(STA)阐明了研究BIG1-98的第二个主要问题,即他莫昔芬和来曲唑的序贯治疗是否优于单药治疗。分析发现换药组的无病生存期、总生存期、无全身疾病生存期或无远端疾病生存期与单药治疗组的相比并无显著差异(表4)。

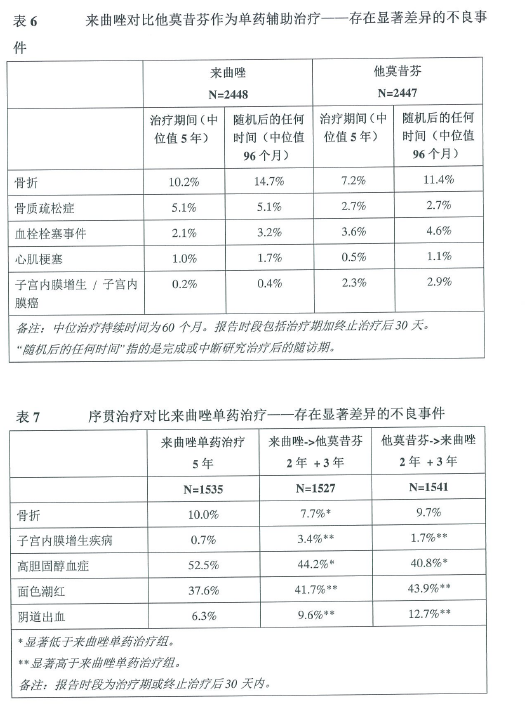
研究D2407(CFEM345D2407)
研究D2407是一项开放、随机、多中心、上市批准后进行的安全性研究,目的是比较来曲唑与他莫昔芬辅助治疗对骨密度(BMD)和血清脂质指标的影响。共有263例患者随机接受来曲唑治疗5年(133名绝经后女性),或在他莫昔芬治疗2年后接受来曲唑治疗3年(130名患者)。BMD和血清脂质的所有评估均在专科中心实验室治疗设盲的情况下开展。BMD和血清脂质的主要分析在第2年。
在第二年,主要终点方面观察到统计学显著差异;腰椎(L2-L4)BMD显示,来曲唑组中位降低4.1%,他莫昔芬组中位增加0.3%。全髋BMD结果与腰椎BMD结果类似,但差异无显著性。
在5年的治疗中,基线BMD正常患者没有一例出现骨质疏松,一例基线骨质减少的患者(T评分-1.9)在治疗期间出现了骨质疏松(中心审查评估结果)。
5年治疗结束时,两组间的治疗差异有所减少,比如在方案定义的临床相关BMD相关变化方面,两组总体并无统计学差异,但在BMD和骨骼事件方面仍存在明显差异。在基线T评分正常的患者中,来曲唑组患者较序贯治疗组有更多患者在一年内腰椎BMD下降至少6%或在整个治疗期内累计下降至少8%。尽管在骨折方面,总体上两个治疗组之间并无显著差异,但序贯治疗组有3/4的骨折发生于改用来曲唑之后。临床骨折和即将发生的骨折更易发生于骨骼受损的患者,即基线BMD的T评分更低的患者以及有骨折病史的患者。
他莫昔芬组在6个月时总胆固醇水平(空腹)中位下降16%,并且在他莫昔芬治疗持续期间一直保持这一水平。在来曲唑组,整个治疗期间总胆固醇水平相对稳定。他莫昔芬组低密度脂蛋白胆固醇(LDL)水平下降但来曲唑组保持稳定。因此,在研究的前2年中,他莫昔芬较来曲唑在总胆固醇、低密度脂蛋白胆固醇和高密度脂蛋白胆固醇:低密度脂蛋白胆固醇(HDL:LDL)比率方面有统计学显著差异。两个治疗组之间甘油三酯无显著差异。
研究FACE(CFEM345D2411)
CFEM345D2411是一项对本品和阿那曲唑进行临床评估(FACE)的开放、随机、多中心IIIb研究,在激素受体阳性和淋巴结阳性乳腺癌的绝经女性中比较来曲唑和阿那曲唑的辅助治疗。根据淋巴结状态和HER-2状态进行随机化分层。意向治疗人群(ITT)由共4136名患者组成(2061名患者接受来曲唑,2075名患者接受阿那曲唑)。安全性分析集由4111名患者组成(2049名患者接受来曲唑,2062名患者接受阿那曲唑)。
研究治疗的中位暴露时间是60个月(按照计划5年)。中位随访期约65个月。36.1%来曲唑组患者和38.1%阿那曲唑组患者在未满5年时终止治疗。
研究主要目的是比较无病生存(DFS)率。该研究设计从以事件为基础修改为以时间为基础,主要是因为该研究中的DFS事件发生率低,统计学很难检测治疗组之间微弱的DFS差。次要有效性参数是总生存期(OS)、至发生远端转移时间、至发生对侧乳腺癌时间以及远期DFS。在任何有效性终点未观察到显著差异。来曲唑组降低了预计7%的复发风险(HR 0.93;95% CI 0.80,1.07,P=0.31)。OS两组并无显著不同。来曲唑组死亡率为11.4%,阿那曲唑组死亡率为11.7%。
后续强化辅助治疗
研究MA-17(CFEM345MA17)
在一项多中心、双盲、随机、安慰剂对照研究(MA-17)中,5100多名完成他莫昔芬辅助治疗(4.5至6年)后受体阳性或受体状态不详的原发性乳腺癌绝经后患者随机接受来曲唑或安慰剂治疗为期5年。
主要终点是无病生存期,定义是从随机直至最早发生区域局部复发、远处转移、或对侧乳腺癌之间的时间。
中位随访28个月时进行主要分析(25%的患者随访至38个月)显示,与安慰剂比较来曲唑使复发风险显著降低42%(风险比 0.58;95%CI:0.45-0.76;P=0.00003)。且无论淋巴结状态,来曲唑较安慰剂均明显获益。在总生存期方面未见显著差异(来曲唑组51例死亡;安慰剂组62例死亡;HR 0.82;95%CI:0.56-1.19)。
因此,该研究在首次期中分析之后进行揭盲,继续以开放的形式进行研究,允许安慰剂组患者改用来曲唑治疗,最多为期5年。未选择换药的患者后续仅进行观察。60%以上的符合标准患者(即在揭盲时无疾病)选择改用来曲唑。最终分析包括在完成他莫昔芬辅助治疗后在中位时间31个月(范围12-106个月)时从安慰剂改为来曲唑的1551名女性患者。换药后来曲唑的中位治疗持续时间为40个月。
中位随访62个月的更新最终分析证实,与安慰剂组相比,来曲唑组乳腺癌复发风险显著降低。

在MA-17骨骼分项研究中,患者同时接受钙和维生素D,发现来曲唑治疗患者自基线的BMD下降幅度大于安慰剂治疗患者。唯一具有统计学显著差异的结果出现在第2年,为全髋BMD的对比(来曲唑组中位降幅3.8%对比安慰剂组中位降幅2.0%)。
在MA-17血脂分项研究中,总胆固醇或任何血脂指标在来曲唑和安慰剂之间均无显著差异。
在更新的生活质量分项研究中,身体方面的总分或精神方面的总分,或SF-36分析中任何模块的评分,在两种治疗之间均无显著差异。在围绝经期生活质量分析(MENQOL)中,来曲唑组中受雌激素剥夺产生的症状(通常发生于治疗的第一年)-面色潮红和阴道出血影响最大的患者比例显著高于安慰剂组。在两个治疗组中均有大部分患者出现的症状为肌肉疼痛,两组间的差异具有统计学显著性,对比结果对安慰剂组更有利。
研究MA-17R(CFEM345MA17E1)
CFEM345MA17E1(MA-17R)是加拿大国家癌症研究所(NCIC)临床试验小组(CTG)在美国和加拿大发起的一项随机双盲研究,旨在比较来曲唑和安慰剂在早期乳腺癌女性,用于完成五年辅助芳香酶抑制剂(AI)治疗后的治疗,无论AI是作为初始治疗或他莫昔芬之后的序贯治疗(包括已参与MA-17研究的女性)。该研究根据淋巴结状态、既往辅助化疗情况、末次AI治疗给药和随机化之间的间隔,以及既往他莫昔芬治疗持续时间进行随机化分层,共有1918名绝经后女性入组(每个治疗组959名患者)。
入组患者中位年龄是65岁。入组前患者初次诊断乳腺癌的中位时间是10.6年。患者入组前服用他莫昔芬的中位时间是5年,接受AI治疗的中位时间是5年。研究治疗的中位持续时间是5年,中位随访期是中位6.3年。
主要有效性终点是无病生存期(DFS),即乳腺癌复发事件或对侧乳腺癌事件,但不包括死亡事件。
在中位时间为6.3年的随访期中,来曲唑组中发生67例DFS事件,安慰剂组中发生98例(HR 0.66;95% CI 0.48,0.91,P=0.01)。与安慰剂相比,来曲唑组显著降低对侧乳腺癌风险(HR 0.42;95% CI 0.22,0.81;P=0.007)。总生存两组没有显著差异(HR 0.97;95% CI 0.73,1.28;P=0.83)。
一线治疗
研究CFEM345C P025
进行了一项双盲、对照研究,对比来曲唑2.5mg与他莫昔芬20mg作为晚期乳腺癌绝经后女性患者的一线治疗的情况。在907名女性患者中发现,在疾病进展的时间(主要终点)和总客观缓解率,治疗失败的时间和临床获益方面,来曲唑都优于他莫昔芬。结果的总结见表9。
表9 在中位随访32个月时的结果
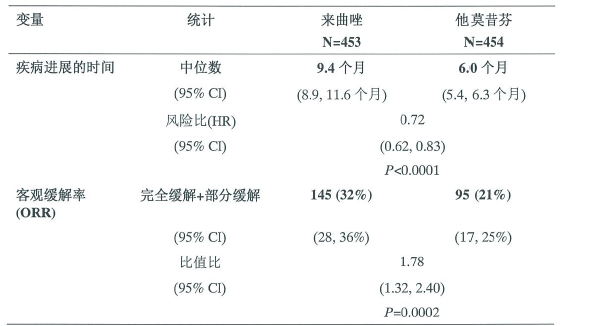
不考虑是否给予了辅助抗雌激素治疗的统计结果得出,来曲唑组疾病进展的时间显著更晚,缓解率显著更高。不考虑乳腺癌的主要位置的统计结果也得出,来曲唑组疾病进展的时间显著更晚。在仅存在软组织疾病的患者中,来曲唑治疗患者的疾病进展的中位时间为12.1个月,他莫昔芬治疗患者为6.4个月;在存在脏器转移的患者中,来曲唑治疗患者的疾病进展的中位时间为8.3个月,他莫昔芬治疗患者为4.6个月。
根据研究设计,患者在疾病进展后可以改用另一种治疗或退出研究。大约50%的患者交叉到另一治疗组,交叉实际上在36个月内完成。至发生交叉的中位时间为17个月(来曲唑→他莫昔芬)和13个月(他莫昔芬→来曲唑)。
来曲唑作为晚期乳腺癌的一线治疗时,患者的中位总生存期为34个月,而他莫昔芬治疗患者为30个月(Log rank检验p=0.53,差异无显著性)。来曲唑治疗在总生存期方面不具优势的原因可能是研究采用了交叉设计。
二线治疗
两项在绝经后、既往接受过抗雌激素治疗的晚期乳腺癌患者中进行的对照研究,分别对比了两种剂量的来曲唑(0.5mg和2.5mg)与醋酸甲地孕酮和安鲁米特的疗效。
研究AR/BC2
2.5mg的来曲唑与醋酸甲地孕酮相比,在总客观缓解率(24%对16%,p=0.04)和治疗失败时间(p=0.04)方面均显示了统计学上的显著性差异,对比结果有利于来曲唑。总生存率及疾病进展时间在两治疗组无显著性差异(分别为p=0.2和p=0.07)。
研究AR/BC3
2.5mg来曲唑治疗组在疾病进展时间(p=0.008)、治疗失败时间(p=0.003)和总生存期(P=0.002)等方面均显著优于安鲁米特治疗组(250mg每日两次)。在该研究中,2.5mg来曲唑与安鲁米特相比在缓解率方面无显著性差异(p=0.06)。
研究FEM-INT-01
研究FEM-INT-01是比较来曲唑2.5 mg每日一次与阿那曲唑1 mg每日一次的一项大型IIIb/IV期随机、多中心、开放研究。中位疾病进展时间是研究的主要研究终点,在两个治疗组之间无显著性差异(约6个月)。来曲唑在客观缓解率方面显著优于阿那曲唑(19% vs 12%,P=0.013)。
男性乳腺癌
尚未研究过来曲唑用于治疗男性乳腺癌的情况。
药理作用
部分乳腺肿瘤的生长受到雌激素的刺激,或者依赖于雌激素的存在。激素反应性乳腺癌(即雌激素和/或黄体酮受体阳性或受体状态不详)的治疗包括各种降低雌激素水平(卵巢切除术、肾上腺切除术、垂体切除术)或抑制雌激素作用(抗雌激素药物和孕激素类药物)的治疗。在一些女性患者中,这些介入治疗导致肿瘤体积缩小或肿瘤生长进展延迟。
在绝经后女性中,雌激素主要来自于芳香化酶的作用,芳香化酶将肾上腺雄激素(主要是雄烯二酮和睾酮)转化为雌酮和雌二醇。因此,通过特异性地抑制芳香化酶可以抑制周围组织和癌组织本身的雌激素生物合成。
来曲唑是芳香化酶系统的一种非类固醇竞争性抑制剂,它能抑制从雄激素到雌激素的转化。在无肿瘤或荷瘤的成年雌性动物中,来曲唑在降低子宫重量、提高血清LH和导致雌激素依赖性肿瘤的消退方面与卵巢切除术同等有效。与卵巢切除术相比,来曲唑治疗不会导致血清FSH上升。来曲唑可以选择性地抑制性腺类固醇生成,但是对肾上腺盐皮质激素或糖皮质激素的生成没有显著作用。
来曲唑通过与细胞色素P450酶中的亚铁血红素竞争性结合来抑制芳香化酶,从而降低所有组织中的雌激素生物合成。经来曲唑治疗的女性患者的血清雌素酮、雌二醇和硫酸雌素酮显著降低,而对肾上腺皮质类固醇、醛固酮或甲状腺激素的合成没有显著影响。
毒理研究
遗传毒性:来曲唑Ames试验、大肠杆菌试验和大鼠微核试验结果均为阴性;CHK1和CCL61中国仓鼠卵巢细胞试验结果阳性。
生殖毒性:在小鼠、大鼠和犬重复给药毒性试验中,当剂量分别为0.6、0.1和0.03mg/kg(按体表面积计算,分别约为人体临床每日最大推荐剂量的1倍、0.4倍和0.4倍)时,可见雌性动物出现性冷淡,雌雄动物均岀现生殖系统萎缩。
雌性大鼠从交配前2周至妊娠第6天经口给予来曲唑,剂量≥0.03mgkg/日(按体表面积计算,约为临床推荐剂量的0.1倍)时,交配成功和妊娠率降低。剂量≥0.003mg/kg/日(按体表面积计算,约为人体临床推荐剂量的0.01倍)时,着床前丢失增加。
妊娠大鼠在器官形成期给予来曲唑,剂量>0.003mg/kg(按体表面积计算,相当于人体临床每日最大推荐剂量的0.01倍)时具有胚胎毒性和胎仔毒性,表现为宫内死亡,吸收胎、着床后丢失增加,活胎数减少和胎仔畸形(包括肾乳头缺失或短小),输尿管扩张、水肿,额骨和跖骨骨化不全。来曲唑在大鼠中具有致畸性,在剂量003mg/kg (按体表面积计算,约为临床每日最大推荐剂量的0.1倍)时,可见胎仔圆头畸形和颈椎/椎体融合。
兔中来曲唑在剂量≥0.002mg/kg时可见胚胎毒性,0.002mg/kg时可见胎仔毒性(按体表面积计算,分别相当于临床每日最大推荐剂量的1/10000和1/10000)。胎仔畸形包括颅骨、胸骨、前肢和后肢骨骨化不全。
幼年大鼠(出生后第7天)经口给予来曲唑0.003、0.03、0.3mg/kg/日,连续12周,在药物暴露量低于临床剂量2.5mg/日的预期暴露量时,可见对骨骼/生长的不良影响(骨成熟,骨密度)、对下丘脑垂体-卵巢轴的神经内分泌和生殖发育的干扰。生育力下降伴随出现脑下垂体过度增大和睾丸变化(包括输精管上皮退化)和雌性动物生殖系统萎缩。该研究中,停药42天后,在相当于临床暴露量的剂量组中,组织病理学变化不可逆。
致癌性:小鼠致癌性试验中,经口给予来曲唑06~60mg/kg/日(按体表面积计算,约为临床每日最大推荐剂量的1~100倍),连续2年,可见良性卵巢间质瘤的发生率剂量相关性上升。如果将生存期较短的高剂量组排除,雌性动物中同时出现肝细胞腺瘤和肝细胞癌的趋势显著。在另外一项试验中,小鼠给药剂量为60mg/kg/日时,血浆AUC0-12h比乳腺癌患者推荐剂量下血浆AUC0-12h高55倍。
大鼠致癌性试验中,经口给予来曲唑0.1~10mg/kg/日(按体表面积计算,约为临床每日最大推荐剂量的0.4~40倍),连续2年,给药剂量10mg/kg/日时,良性卵巢间质瘤发生率上升。雌性大鼠在剂量≥0.1mg/kg/日时可见卵巢增生。在剂量为10mg/kg/日时,大鼠中的血浆AUCo24h比乳腺癌患者推荐剂量下血浆AUC0-12h高80倍。
在小鼠和大鼠中观察到的良性卵巢间质瘤可能与抑制雌激素合成的药理作用有关,也可能是循环雌激素下降引起促黄体激素上升导致的。
吸收
来曲唑在胃肠道吸收迅速、完全,平均绝对生物利用度为99.9%。同时进食可轻度降低来曲唑的吸收率(中位tmax:1小时[空腹]对比2小时[进食];平均Cmax:129±20.3nmol/L[空腹]对比98.7±18.6nmol/L[进食]),但对其吸收程度(AUC)无影响。对来曲唑吸收率的轻度影响被认为有没有临床意义,因此,来曲唑可在进食前、后或同时服用。
分布
60%的来曲唑与血浆蛋白结合,主要是白蛋白(55%)。来曲唑在红细胞中的浓度是其血浆浓度的80%。应用14C标记的来曲唑2.5mg后,血浆中82%的放射活性物质为原形药物,因此全身的代谢产物很少。来曲唑在组织中分布迅速、广泛,稳态时的表观分布容积为1.87±0.47 L/kg。
生物转化/代谢
来曲唑主要的消除途径是转变为无药理活性的甲醇代谢物(清除率=2.1L/h),但与肝脏血流(约为90L/h)相比这个速度相对较慢。细胞色素P450同工酶3A4和2A6可将来曲唑转化为这种代谢产物。少量未检测出的代谢物的生成以及直接经肾脏和粪便排出的药物在来曲唑的总清除中只占很小的一部分。健康绝经后志愿者接受2周14C标记的来曲唑2.5mg后,从尿液中回收的放射活性物质为应用剂量的88.2±7.6%,而粪便中的为3.8±0.9%。直到用药后216小时从尿液中收集到的放射活性物质至少有75%(剂量的84.7±7.8%)为葡萄糖醛酸化的甲醇代谢物,约9%为两种未鉴定的代谢物,6%为原形的来曲唑。
消除
血浆的终末半衰期为2-4天。每日应用来曲唑2.5mg,在2-6周内可达到稳态水平。稳态水平的血浆浓度比单次应用来曲唑的血浆浓度高近7倍,比根据单次用药推算出的稳态浓度高1.5-2倍,表明每日应用来曲唑2.5mg的药代动力学存在轻度的非线性关系。因为治疗中能长期保持稳态水平,因此推断没有来曲唑的持续蓄积作用。
线性/非线性
来曲唑在单次口服剂量高达10mg(剂量范围0.01-30mg)以及日剂量高达1.0mg(剂量范围0.1-5mg)时,药代动力学呈剂量比例。在单次口服30mg后,AUC上升幅度略微超出剂量比例。与日剂量1.0mg相比,在日剂量2.5mg和5mg时,AUC分别上升了3.8倍和12倍,而不是分别上升了2.5倍和5倍。因此,推荐剂量2.5mg/日是一个边界剂量,在该剂量时出现明显的超剂量比例,而在5mg/日时,超剂量比例变得更明显。超剂量比例有可能是代谢消除过程达到饱和引起的。在研究的所有剂量水平(0.1mg/日-5mg/日)下,给药1-2个月过后均达到稳态水平。
特殊人群
老年患者
年龄对来曲唑的药代动力学无影响。
肾功能受损
一项涉及16名绝经后不同肾功能水平(24小时肌酐清除率9-116ml/min)的志愿者的研究表明,单次应用来曲唑2.5mg后,肾功能对其药代动力学没有影响。另外,在晚期癌症患者中,肾功能不良(计算的肌酐清除率为20-50ml/min)对来曲唑的浓度无影响。除了评估肾功能受损对来曲唑的影响的上述研究之外,还对两项关键研究(研究AR/BC2和研究AR/BC3)的数据进行了协变量分析。计算得出的肌酐清除率(CLcr)[研究AR/BC2的范围:19-187ml/min;研究AR/BC3的范围:10-180ml/min]显示与来曲唑的稳态血浆谷浓度(Cmin)之间并无统计学显著关连。此外,作为转移性乳腺癌二线治疗的研究AR/BC2和研究AR/BC3的数据显示,未见来曲唑对CLcr有不良作用或导致肾功能受损的证据。
因此,对于肾功能受损(CLcr≥10 ml/min)患者无需调整剂量。重度肾功能受损(CLcr<10 ml>肝功能受损
一项涉及不同肝功能水平的研究中,有中度肝功能损害的志愿者的平均AUC比肝功能正常者高出37%,但仍在肝功能正常志愿者的范围值之内。一项对比8例肝硬化、严重肝功能不全的患者和8例健康志愿者单次应用来曲唑后的药代动力学的研究表明,前一组患者的AUC和T1/2 分别升高95%和187%。因此,可以预期在有严重肝功能损害的乳腺癌患者中与没有肝损害的患者相比,来曲唑的浓度将会升高。由于在每日接受5或10mg来曲唑的患者中没有发现毒性增加,因此在有严重肝功能不良的患者中无须调整剂量。但是,应对这些患者密切观察。此外,在两项涉及359例晚期乳腺癌患者的良好对照的研究中,在所研究的来曲唑浓度下未见肾功能受损(计算得出的肌酐清除率:20-50ml/min)或肝功能受损的影响。
30℃以下贮藏。避免儿童误取。
PVC/PE/PVDC铝塑包装。10片/盒或30片/盒。
60个月
进口药品注册标准JX20130078
进口药品注册证号: H20140149
FDA妊娠分级:D