雷珠单抗注射液
诺适得 Lucentis
Ranibizumab Injections
Lei Zhu Dan Kang Zhu She Ye
活性成份:雷珠单抗
化学名称:G1,抗-(人血管内皮生长因子)Fab片段(人-鼠单克隆rhuFabV2γ-1链),二硫键结合人-鼠单克隆rhuFabV2κ-链)
分子量:48KD
透明至微乳白色液体。
【处方组成】
每1ml 含 10mg 雷珠单抗,预装在注射器中。
本品所含辅料为:α,α-海藻糖二水合物;组氨酸;盐酸组氨酸一水合物;聚山梨醇酯 20。
用于治疗湿性(新生血管性)年龄相关性黄斑变性(AMD)。
10mg/ml,每瓶装量0.165ml。
本品应在有资质的医院和眼科医生中使用。医院应具备该疾病诊断和治疗所需的相关仪器设备和条件,眼科医生应具备确诊湿性年龄相关性黄斑变性的能力和丰富的玻璃体内注射经验。
本品经玻璃体内注射给药。推荐剂量为每次0.5mg(相当于0.05ml的注射量),每月一次给药。
如果不能长期每月注射给药,也可在初始3个月连续每月注射1次给药之后,按每3个月注射给药1次。与持续每月注射相比,在初始3个月,连续每月注射之后的9个月治疗中,如果按每3个月给药1次,则视力改善将平均减少约5个字母(ETDRS视力或Snellen视力表1行)。
治疗期间应每月监测患者视力变化情况,如果出现显著的视力下降,需进一步接受本品注射治疗。两次注射之间的间隔时间不得小于一个月。
给药方法:
在玻璃体内注射给药前,应对患者的既往病史进行全面的评估,以评估其发生高敏反应的可能性。(见【警告】与【注意事项】)
本品必须在无菌条件下进行玻璃体内注射,其中包括采用外科手术的手部消毒、无菌口罩、无菌手套、无菌手术单和无菌开睑器(或类似器具)。注射前必须给予患者适当的麻醉剂和眼局部用光谱抗生素。注射前消毒眼周皮肤、眼睑和眼球表面。
应指导患者在每次注射前后3天自行滴注抗生素滴眼液,每天4次。
使用前请参见【 使用和操作以及丢弃说明】
注射针头应于角巩膜缘后3.5~4.0mm处,对准眼球中心,向玻璃体内进针,避免水平进针。
缓慢推送0.05ml注射液,应注意在之后的注射时改变巩膜注射部位。
注射后必须监测患者的眼内压和眼内炎。监测应包括注射后立即检查视神经乳头的血流灌流、30分钟内测眼内压及2~7天后进行检眼镜、裂隙灯和眼底检查。需指导患者立即向其医生报告任何出现的眼内炎的症状(见【注意事项】)。
每支注射液仅用于治疗一只眼的单次注射。如果对侧眼也需要治疗,必须使用新的一瓶注射液,并在向另一只眼注射本品前更换无菌区、注射器、手套、手术单、开睑器、滤过针头和注射针头。
特殊人群用药
肾损害
肾损害患者无需调整用药剂量(见【药代动力学】)。
肝损害
尚无相关研究。由于全身暴露可忽略不计,无须采取特别措施。
儿童与青少年(18岁以下)
尚无相关的安全与有效性数据。不建议儿童与青少年使用本品。
老年患者
无需调整剂量。
在三项Ⅲ期临床试验中共有1315名患者组成了安全性人群。所有患者接受至少24个月的本品治疗。440名患者接受了0.5mg的推荐剂量的治疗。
以下严重不良事件与注射操作有关:眼内炎、孔源性视网膜脱离、视网膜撕裂和医源性外伤性白内障(见【注意事项】)。
在接受本品治疗的患者观察到的其他严重眼部不良事件包括眼内炎症与眼内压升高(参见【注意事项】)。
在三项对照的Ⅲ期试验FVF2598g(MARINA)、FVF2587g(ANCHOR)和FVF3192(PIER)合并的数据中,以下列出的不良事件在0.5mg本品治疗组中的发生率(至少高出2个百分点)高于对照组(假注射治疗或维替泊芬光动力疗法[PDT])。因此这些被认为是潜在的药物不良反应。下文提供的安全性数据还包括所有440例接受0.5mg本品的合并患者人群中发生的至少与注射本身或医药产品可能有关的不良事件。
不良反应按系统器官类别和频率列出,频率使用以下规定:很常见(>1/10),常见(>1/100至<1/10),不常见(>1/1000至<1/100),罕见(>1/10000至<1/1000),非常罕见(<1/10000)。


免疫原性:
与所有治疗性蛋白相似,在接受本品治疗的患者中可能出现免疫应答。免疫原性数据反映了在免疫试验中,试验结果提示本品抗体阳性的患者百分比,并高度依赖于试验的灵敏度和特异性。
在不同治疗组中,本品免疫反应性的治疗前发生率为0%~5%。每月注射本品,为期6至24个月后,大约1%至8%的患者中可检出本品抗体。
目前,对本品的免疫反应性的临床显著意义尚且不明。在免疫反应性水平最高的新生血管性年龄相关的黄斑变性患者中,部分可出现虹膜炎或玻璃体炎。
对本品或本品成份中任何一种辅料过敏者禁用。
活动的或怀疑的眼部或眼周感染的患者。
活动期眼内炎症的患者。
玻璃体内注射,包括本品注射,与眼内炎、眼内感染、孔源性视网膜脱离、视网膜撕裂和医源性外伤性白内障有关(参见【不良反应】)。本品注射时必须采用合格的无菌注射技术。此外,注射后一周内应监测患者的情况,从而早期发现感染并治疗。应指导患者在出现任何提示有眼内炎的症状或任何上述提到的事件时,应立即报告给医生。
本品注射后60分钟内可观察到眼内压升高(参见【不良反应】)。因此须同时对眼内压和视神经乳头的血流灌注进行监测和适当治疗。
玻璃体内使用血管内皮生长因子(VEGF)抑制剂后,存在潜在的动脉血栓栓塞事件的风险。在临床Ⅲ期研究中,动脉血栓栓塞事件的发生率在本品和对照组之间是相近的。接受本品0.5mg的患者与本品0.3mg或对照相比,卒中的发生率在数值上较高,不过此差异并无统计学显著性。卒中率的差异在具有已知卒中风险因子的患者,包括既往卒中病史或短暂性脑缺血发作史的患者中更大。因此主治医生应对这些患者谨慎评价本品治疗是否合适,以及治疗益处是否超过了潜在的风险。
与所有治疗用蛋白质药物一样,本品有潜在的免疫原性。
现有有限的数据未提示双眼同时治疗(包括双眼于同一天内给药)会增加发生全身不良事件的风险。
本品不得与其他抗血管内皮生长因子(VEGF)药物同时使用(全身或局部使用)。
出现下述情况,应暂停给药,且不得在下次计划给药时间之前恢复给药:
与上次的视力检查相比,最佳矫正视力(BCVA)的下降≥30字母;
眼内压≥30mmHg;
视网膜撕裂;
涉及中心凹中央的视网膜下出血,或出血面积占病灶面积的50%或更多;
在给药前后的28天已接受或计划接受眼内手术。
接受抗-VEGF治疗湿性AMD之后,视网膜色素上皮撕裂的风险因素包括大面积的和/或高度隆起的视网膜色素上皮脱离。在具有这些视网膜色素上皮撕裂风险因素的患者中开始本品治疗时应谨慎。
在孔源性视网膜脱离或3或4级黄斑裂孔患者中应中断治疗。
本品治疗可引起短暂的视觉障碍,这可能影响驾驶或机械操作的能力(参见【不良反应】)。出现这些症状的患者在这些暂时性的视觉障碍副作用消退前不能驾驶或进行机械操作。
妊娠
目前尚无本品在妊娠妇女中使用的数据。未进行本品的动物生殖研究。同样尚不清楚妊娠妇女使用本品是否会对胎儿造成伤害,或者会影响生育能力。本品不得用于妊娠妇女,除非预期利益超过对于胎儿的潜在风险时才可考虑使用。
有生育力的妇女
有生育能力的妇女应在治疗期间采取有效的避孕措施。
哺乳
不清楚本品是否分泌入人乳汁中。作为预防性措施,建议患者在本品治疗期间不要哺乳。
由于缺乏此亚组人群的安全与有效性数据,因此不建议儿童与青少年使用本品。
在临床试验中,大约82%(1146/1406)的随机接受本品治疗的患者年龄≥65岁,大约55%(772/1406)的患者年龄≥75岁。在这些试验中,随着年龄增加,本品的有效性或安全性未出现显著差异。在人群药代动力学分析中,经过肌酐消除率校正后,年龄对于全身暴露水平不存在显著影响。
目前尚未进行正式的药物相互作用研究。
临床试验与上市后数据中已报告了意外用药过量的病例。与这些报告的病例最常相关的不良事件有眼内压升高和眼痛。如果出现药物过量,应监测眼内压并治疗(如果主治医生认为有必要时)。
药效动力学性质
本品是一种人源化的重组单克隆抗体片段(Fab),靶向抑制人血管内皮生长因子A(VEGF-A)。它与VEGG-A亚型(即VEGF110、VEGF121、VEGF165)以较高的亲和力,从而抑制了VEGF-A与其受体VEGFR-1和VEGFR-2的结合。VEGFA与其受体结合,可导致血管内皮细胞增殖和新生血管形成,以及增加血管渗漏,所有这些被认为与新生血管性年龄相关性黄斑变性(AMD)的进展相关。
在新生血管性年龄相关性黄斑变性(AMD)患者中进行的三项随机、双盲、假注射*或阳性对照的研究,评估了本品治疗的临床安全性与有效性。总计1,323名病人(879名本品治疗组和444名对照组)入组至这三个临床Ⅲ期试验中。在研究FVF2598g(MARINA)中,轻微典型性或隐匿型不含典型性CNV患者每月接受本品0.3mg或0.5mg或假注射的玻璃体内注射。总计716名患者入组此研究(假注射治疗组238名;本品0.3mg组238名;本品0.5mg组240名)。获得了24个月的研究数据。
在研究FVF2587g(ANCHOR),典型性为主型CNV病变的患者接受:1)每月玻璃体内0.3mg本品注射与假PDT治疗;2)每月玻璃体内0.5mg本品注射与假PDT治疗;或者3)假注射玻璃体内注射与活性的维替泊芬PDT治疗。本品首次注射后,同时给予假注射*的或活性的维替泊芬PDT治疗,之后如果荧光素血管造影显示受试眼中血管渗漏持续存在或复方,每三个月进行一次治疗。总计423名患者入组此研究(假注射治疗组143名;)本品0.3mg组140名;本品0.5mg组140名)。获得至24个月的研究数据。
在两项研究中,最初的有效性观察指标为维持视力的患者比例,定义为第12个月时与基线相比视力下降小于15个字母。几乎所有(约95%)接受本品治疗的患者在治疗12个月后保持了视力。34%至40%接受本品治疗的患者出现有临床意义的视力改善,定义为在第12个月,视力增加15个字母或以上。病变大小对结果无显著的影响。详细结果列于下表。


在MARINA和ANCHOR研究中,第12个月时,0.5mg雷珠单抗治疗组中观察到视力改善的同时,亦伴随了患者报告受益(以国立眼科研究所视功能调查问卷(VFQ-25)评分作为评价)。0.5mg雷珠单抗和两个对照组之间的差异的p-值范围为0.009至<0.0001。
两项试验的结果显示,继续雷珠单抗治疗对于在治疗第一年最佳矫正视力(BCVA)下降15个字母或以上的患者也有益。
对于使用本品治疗超过36个月而言,尚未开展研究。
研究FVF3192g(PIER)为一项随机、双盲、假注射对照研究,目的是评价本品在所有类型的新生血管AMD患者中的安全性和有效性。患者在前三月内每月一次接受0.3mg(n=60)或0.5mg本品(n=61)玻璃体内注射或者玻璃体内假注射(n=63),之后每三月给药一次。从第14个月开始,允许假注射的患者改为接受雷珠单抗治疗,从第19个月开始,可能进行更频繁的治疗。在PIER研究中,本品治疗的患者平均接受了10次治疗。
主要疗效终点为:相对于基线值,治疗第12个月时视力的平均改变。在最初的视力增加之后(每月一次给药后),在每三个月给药一次期间患者视力普遍出现下降,在第12个月回到基线值,且在第24个月时大部分接受本品治疗的患者(82%)保持这一疗效。有些患者在一年假注射治疗后改为接受雷珠单抗治疗,其用药情况表明,早期使用雷珠单抗或许能更好地维持视力。
在32位患者中开展了一项开放标签研究(PROTECT),随访期为9个月,评价了维替泊芬PDT和0.5mg雷珠单抗同一天给药的安全性。该研究的结果表明,初始治疗后眼内炎症的发生率为6.3%(2/32)。
研究FVF3689g(SAILOR)为一项临床Ⅲb期,单盲、一年期多中心研究,在之前未经治疗和经治疗的AMD继发CNV受试者中进行。主要研究目标是评估接受12个月治疗的受试者中,眼部和非眼部严重不良事件的发生率。2378名患者以1:1比例随机分配接受每月一次玻璃体内0.3mg或0.5mg本品治疗连续三个月,之后按需再治疗,频率不超过每月一次。
总体而言,两个剂量组之间没有观察到眼部和非眼部不良事件的发生率有不平衡。统计学分析没有显示0.5mg组卒中发生率有增高的趋势,各自的卒中总体发生率的95%置信区间较宽(0.3mg组为0.3%至1.3%,相比0.5mg组为0.7%至2.0%)。两个给药组中发生卒中的患者数量均较小,不能得出结论(或排除)治疗组之间的卒中率确实有差异。卒中率的差异在具有已知卒中风险因子的患者,包括既往卒中病史或短暂性脑缺血发作史的患者中更大。
*假注射对照操作为使用与本品玻璃体内注射相同的方式进行麻醉,然后使用无针头的注射器顶部压向结膜,并推针。
短尾猴双侧玻璃体腔内注射雷珠单抗0.25mg/眼至2.0mg/眼的剂量范围,每2周一次,持续26周,出现剂量依赖的眼部影响。
注射后2天,前房闪辉与细胞出现剂量依赖性增加并达到峰值。炎性反应的程度在随后注射治疗中或恢复期内通常减轻,但并未在所有病例中完全恢复。在眼后节,发生玻璃体浑浊,该症状同样有剂量依赖性倾向,且一般持续至治疗期结束。在26周的研究中,玻璃体炎症反应的严重程度随注射次数而增加。恢复期后观察到可逆的迹象。后节炎症的自然病程和持续时间显示这是免疫介导的抗体反应,没有临床相关性。在相对长期的严重炎症后,在一些动物中观察到白内障形成,提示晶状体的改变更可能是继发于严重的炎症。在玻璃体内注射药物后观察到眼内压出现短暂的升高,这一反应与剂量大小无关。
眼组织的显微镜改变全部与炎症有关,没有显示有任何眼结构的变性过程。在有些眼的视神经盘中观察到肉芽肿炎性改变。这些后段的变化在恢复期中减轻,有些病例中完全消失。本品玻璃体内注射后未发现全身毒性特征。在部分接受给药的动物中发现血清和玻璃体内中有本品的抗体。
尚无本品在动物中致癌、致突变和生殖毒性与发育毒性的数据。
新生血管性AMD患者每月接受本品玻璃体内注射后,本品的血清浓度通常较低,血清浓度峰值(Cmax)一般低于可50%抑制VEGF的浓度(11~27ng/ml,根据细胞增殖检测的评估)。在0.05至1.0mg/眼的剂量范围内血清Cmax与剂量成比例。
基于群体药代动力学分析和本品在接受0.5mg剂量的患者的血清中的消除,本品在玻璃体力的平均消除半衰期约为9天。每月玻璃体内注射本品0.5mg/眼后,在给药后约1天达血清Cmax,预期一般范围在0.79和2.90ng/ml之间,预期Cmin一般范围在0.07和0.49ng/ml之间。本品的血清浓度比玻璃体中的浓度低90000倍。
肾功能损伤患者:尚未在肾功能受损患者中进行本品药代动力学的正式研究。在患者群体药代动力学分析中,54%(389/725)为肾功能受损患者(39%为轻度,12%为中度,2%为重度)。在肾功能受损患者中,本品清除率的下降无临床显著意义。因此不需要进行剂量调整。
肝功能损伤:尚无有关本品在肝功能损害患者中药代动力学的正式研究。
本品需封存在原包装中2~8℃避光保存,不得冷冻。
请在儿童不可触及的地方贮存。
0.165mL无菌溶液预装在注射器(Ι型玻璃)内,注射器有溴化丁基橡胶柱塞和注射器盖,注射器盖由白色防揭封口,灰色溴化丁基胶头端盖和Luer Lock转接头构成。预装药物的注射器有一个柱塞杆和一个手指抓手,包装在密封托盘内。每个包装装有一个预装药物的注射器。
36个月。
进口药品注册标准JS20140110
S20160002
预装药物的注射器仅供一次性使用(请参见第4节【用法用量】)
预装药物的注射器是无菌的。如果包装破损,切勿使用预装药物的注射器。除非托盘依然密封,否则不能保证预装药物的注射器的无菌性。如果溶液变色、浑浊或含有颗粒物,切勿使用预装药物的注射器。
对于玻璃体内注射,应使用30Gx1/2英寸注射针头。
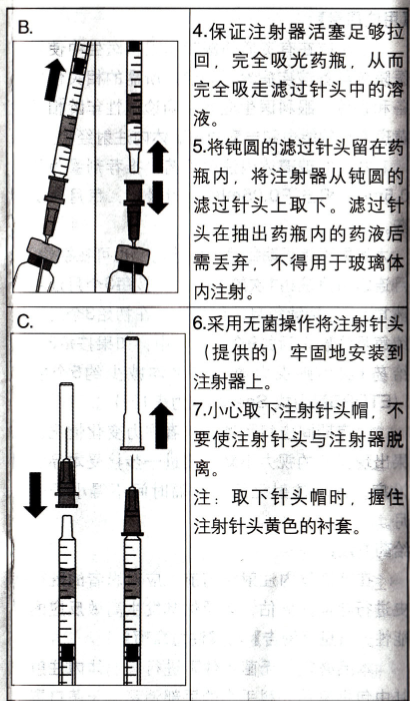
为了配制本品用于玻璃体内注射,请按照以下说明操作: