

阿仑膦酸钠片
福善美® Fosamax®
Alendronate Sodium Tablets
A Lun Lin Suan Na Pian
主要成份为阿仑膦酸钠
化学名称:(4-氨基-1-羟基亚丁 基)二膦酸单钠盐三水合物。
结构式:

分子式:C4H12NNaO7P2·3H2O
分子量:325.12
本品为白色片。
·适用于治疗绝经后妇女的骨质疏松症,以预防髋部和脊柱骨折(椎骨压缩性骨折)。
·适用于治疗男性骨质疏松以增加骨量。
70毫克(以阿仑膦酸计)。
绝经后妇女骨质疏松症的治疗:
推荐剂量为:
每周1次,1次1片70mg
治疗男性骨质疏松症以增加骨量:
推荐剂量为每天一次,1次1片10mg。
本品必须在每天第一次进食、喝饮料或应用其它药物治疗之前的至少半小时,用白水送服,因为其它饮料(包括矿泉水)、食物和一些药物有可能会降低本品的吸收(见[药物相互作用])。
本品应该只能在每周固定的一天晨起时使用。为尽快将药物送至胃部,降低对食道的刺激,本品应在清晨用一满杯白水送服,并且在服药后至少30分钟之内和当天第一次进食前,病人应避免躺卧。本品不应在就寝时及清早起床前服用。否则会增加发生食道不良反应的危险(见[注意事项])。
如食物中摄入不足,所有骨质疏松患者都应补充钙和维生素D(见[注意事项])。
老年患者或伴有轻至中度肾功能不全的患者(肌酐清除率35-60ml/min)不需要调整剂量。因缺乏相关用药经验,对于更严重的肾功能不全患者(肌酐清除率<35ml>患者应该被告知,如果出现漏服的情况,请在记起来后的第二天早晨服用一片,之后依然按照原本正常的服药计划,请勿在同一天内服用两次。
目前尚未确定本产品的最佳疗程。所有经双膦酸盐治疗的患者,都应对是否需要继续使用该类药物进行定期评估。骨折风险较低的患者在用药3至5年后应考虑停用。终止治疗的患者需周期性地对自己的骨折风险进行重新评估。
临床试验经验
由于临床试验实施的条件存在广泛差异,一种药物在临床试验中的不良反应发生率很难与另一种药物直接进行比较,因此可能无法反映临床实践中的实际发生率情况。
治疗绝经后妇女骨质疏松症
每日给药
四项临床试验评估了本品治疗绝经后妇女骨质疏松症的安全性,在这四项试验共入组了7453名女性,年龄为44~84岁。研究1和研究2在设计上一致,都是为期3年的双盲、安慰剂对照的多中心研究(美国和多国;n=994);研究3为骨折干预试验(Fracture Intervention Trial,FIT)中为期3年的椎体骨折队列(n=2027);研究4为FIT研究中为期4年的临床骨折队列(n=4432).整体而言,3620名患者接受了安慰剂治疗,3432名患者接受了阿仑膦酸钠的治疗。这些临床研究还招募了之前已有胃肠道疾病的患者和同时服用非甾体抗炎药物的患者。在研究1和研究2中,所有女性都以碳酸钙的形式摄入了500mg的元素钙。在研究3和研究4中,每日膳食钙摄入低于1000mg的所有女性额外补充每日500mg的钙和250国际单位的维生素D。
在研究1和研究2接受10美mg的阿仑膦酸钠或安慰剂治疗的患者以及研究3和研究4的所有患者之中,因各种原因死亡的发生率在安慰剂组中为1.8%,在阿仑膦酸钠组中为1.8%。严重不良反应的发生率在安慰剂组中为30.7%,在阿仑膦酸钠组中为30.9%。由于临床不良事件而终止研究的患者比例在安慰剂组中为9.5%,在阿仑膦酸钠组中为8.9%。表1显示了这些研究中发生于阿仑膦酸钠或安慰剂组的被研究者判定为可能、很可能或肯定与药物有关且在≥1%患者中报告的不良反应。
表1
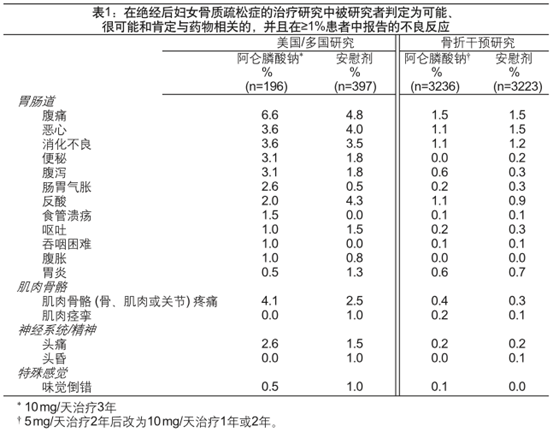
罕见皮疹和红斑。
胃肠道不良反应:1名接受阿仑膦酸钠10mg每日一次的患者有消化道溃疡和胃切除手术史,且同时在服用阿司匹林,该患者发生吻合口溃疡,并伴有微量的出血,研究者认为这与药物有关。终止阿司匹林和阿仑膦酸钠后,患者康复。在研究1和研究2中的患者中,49%-54%在基线时有胃肠道疾病史,54%~89%在研究过程中服用了非甾体类抗炎药物或阿司匹林。(见【注意事项】)。
每周给药
在为期1年的双盲多中心研究中,研究者将每周服用70mg阿仑膦酸钠与每天服用10mg阿仑膦酸钠进行了比较,评估了前者对治疗绝经后骨质疏松症的安全性。阿仑膦酸钠70mg每周一次与阿仑膦酸钠10mg每日一次的总体安全性和耐受性相似。被研究者判定为可能、很可能或肯定与药物相关的,并且在任意一治疗组≥1%患者中报告的不良反应列于表2
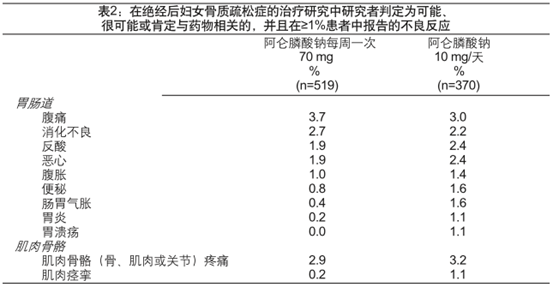
预防绝经后妇女骨质疏松症
每日给药
通过三组双盲、安慰剂对照试验评估40-60岁绝经后女性每天服用阿仑膦酸钠5mg的安全性,这些试验随机选取了1400多名患者服用阿仑膦酸钠2~3年。这些试验表明,每天服用阿仑膦酸钠5mg的患者整体安全性和安慰剂相似。每天服用阿仑膦酸钠5mg的642名患者中有7.5%的人因为临床不良事件而终止试验,服用安慰剂的648名患者的终止率是5.7%。
每周给药
在一项为期一年、双盲且包含723名患者的多中心试验中,对每天服用阿仑膦酸钠5mg的患者和每周服用阿仑膦酸钠35mg的患者进行了评估。阿仑膦酸钠35mg每周一次与阿仑膦酸钠5mg每日一次的总体安全性和耐受性特点相似。
在这些试验中,研究者判定为可能、很可能或肯定与药物相关的且在≥1%患者(阿仑膦酸钠35mg每周一次、阿仑膦酸钠5mg每日一次或安慰剂)中发生的不良反应列于表3。
表3
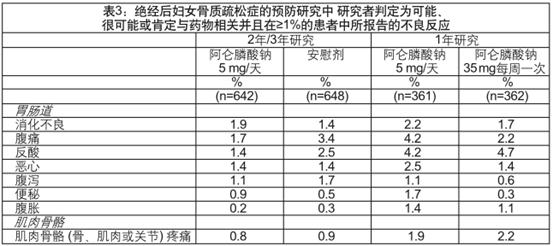
伴随使用雌激素/激素替代疗法
在患有骨质疏松症的绝经后妇女中进行的两项研究中(研究时间分别为1年和2年)(n=853),阿仑膦酸钠10mg每日一次与雌激素±孕酮联合治疗(n=354)的安全性和耐受性与单一治疗相似。
治疗男性骨质疏松症
在两项安慰剂对照、双盲、多中心男性患者研究中(阿仑膦酸钠10mg,每日一次的2年研究,和阿仑膦酸钠70mg每周一次的1年研究),因所有临床不良事件而导致的中止治疗率分别为:阿仑膦酸钠10mg每日一次组为2.7%,相应地安慰剂组为10.5%;阿仑膦酸钠70mg每周一次组为6.4%,相应地安慰剂组为8.6%。在这些研究中,研究者判定为可能、很可能或肯定与药物相关的且在≥2%患者(阿仑膦酸钠或安慰剂)中发生的不良反应列于表4。
表4

糖皮质激素引发的骨质疏松症
在两项为期一年、安慰剂对照、双盲、多中心试验中患者接受糖皮质激素治疗,每天5mg和10mg阿仑膦酸钠的整体安全性和耐受性大致和安慰剂相似。经研究者判定为、很可能或肯定与药物相关的,并且在≥1%每天服用5mg和10mg阿仑膦酸钠或者安慰剂的患者中发生的不良反应见表5。
表5

糖皮质激素引发的骨质疏松症患者所接受的第二年持续性治疗试验(阿仑膦酸钠:n=147),其整体安全性和耐受性与第一年所观察到的一致。
Paget‘骨病
骨质疏松症和paget‘s病临床研究中,3~12个月内每天服用阿仑膦酸钠40mg的175名患者所报告的不良试验类似于每天服用阿仑膦酸钠10mg的绝经后女性中所发生的不良事件。然而,在每天服用阿仑膦酸钠40mg的患者中,上消化道不良反应的发病率明显增加(阿仑膦酸钠为17.7%vs.安慰剂为10.2%)。其中发生了一例食道炎和两例胃炎,并致使治疗终止。
此外,肌肉骨骼(骨骼、肌肉或关节)疼痛出现在患有paget‘s骨病并服用其他双膦酸盐加以治疗的患者中,该病被研究者判定为可能、很可能或肯定与药物相关,并出现在大约6%的每天服用阿仑膦酸钠40mg进行治疗的患者中,而服用安慰剂的患者大约有1%,但很少有患者终止治疗。患有Paget‘病且每天服用阿仑膦酸钠40mg的患者中有6.4%因临床不良事件而终止治疗,而服用安慰剂的患者有2.4%因临床不良事件而终止治疗。
上市后经验
本品在上市后使用过程中,被报告出现下列不良反应。因为这些不良反应来自于无法确定数量的人群自发报告,所以无法可靠估计发生频率,也不能可靠地确定与药物暴露之间的因果关系。
全身反应:过敏反应,包括荨麻疹和血管性水肿。曾经报告服用阿仑膦酸钠后出现一过性肌痛不适、乏力和发热,通常与初始治疗相关。在存在诱因条件时,会发生症状性低钙血症。外周性水肿。胃肠道反应:食管炎、食道糜烂、食管溃疡、罕见食道狭窄或穿孔及口咽溃疡;胃或十二指肠溃疡,某些较为严重并伴有并发症(见[注意事项]及[用法用量])。
局限性下颌骨坏死,可能与拔牙和/或致残的情况(见注意事项);关节肿胀,股骨干低能量骨折和转子下低能量骨折(见注意事项)。
神经系统:头晕喝眩晕。
肺部:急性哮喘加重。
皮肤:皮疹(偶伴对光过敏),搔痒,脱发。严重的皮肤反应,包括Stevens-Johnson综合征和毒性表皮坏死溶解症。
特殊感觉:眼葡萄膜炎、巩膜炎或表层巩膜炎。罕见外耳道胆脂瘤(病灶骨坏死)的报道。
实验室检查结果
在双盲、多中心、安慰剂对照的临床研究中,服用阿仑膦酸钠的患者中分别有约18%和10%出现了轻微且短暂的无症状性血清钙和磷的下降,安慰剂组患者血清钙和磷分别下降了12%和3%。但是血清钙下降到低于8.0mg/dl(2.0mM)的发生率和血清磷下降到低于或等于2.0mg/dl(0.65mM)的发生率在两个治疗组中相似。
本品禁用于以下情况:
·导致食管排空延迟的食管异常,例如狭窄或驰缓不能
·不能站立或坐直至少30分钟者
·对本产品任何成份过敏者
·低钙血症(见[注意事项])
上消化道不良反应
和其它口服二磷酸盐一样,本品可能对上消化道粘膜产生局部刺激。由于本品可能产生的刺激性及存在加重潜在疾病的可能性,有活动性上消化道疾病(Barrett’s食道、吞咽困难、其他食管疾病、胃炎、十二指肠炎或溃疡)的患者服用本品时应予以关注。
在口服双膦酸盐(包括本品)治疗的患者中,已报告的食管不良事件有食管炎、食管溃疡和食管糜烂,偶见出血,罕见食管狭窄或穿孔。其中有些病例,因这些不良反应加重而需住院治疗。因此,医生应该警惕可能发生食管反应的任何症状和体征,患者如果出现吞咽困难、吞咽痛、胸骨后疼痛或新发胃灼热或胃灼热加重,应指导其停用本品并就医。
在口服双膦酸盐(包括本品)后躺卧、和/或无法将双膦酸盐(包括本品)用推荐的一整杯水(175-250ml)送服,和/或出现提示食管刺激的症状后仍继续服药的患者,发生严重食管不良反应的风险更大。因此,向患者提供详尽的用药指导,让其充分理解是很重要的(见[用法用量])。对于那些因智力障碍而不能遵守用药指南的患者,应在适当的监护下应用本品治疗。
已有上市后报告口服使用双膦酸盐会发生胃和十二指肠溃疡,其中有些很严重并伴并发症,尽管对照临床试验中未观察到胃和十二指肠溃疡风险增加。(见[不良反应])。
颌骨坏死
在服用包括本品的双膦酸盐的患者中,可自发报告颌骨坏死(ONJ),这一般与拔牙和/或局部感染伴愈合延迟相关。颌骨坏死的已知风险因素包括侵入性牙齿治疗(如,拔牙、种植牙、骨科手术)、癌症诊断、伴随治疗(如化疗、皮质类固醇药物、血管生成抑制剂)、口腔卫生差、伴随疾病(如牙周病和/或先前存在的牙齿疾病、贫血、凝血病、感染、假牙不合)。接触双膦酸盐的时间越长,颌骨坏死的风险也会随之提高。
对于需要接受侵入性牙科手术的患者,停用双膦酸盐治疗可以降低颌骨坏死的风险。治疗医生和/或口腔外科医生的临床判断应基于个体获益/风险评估,指导每个患者的治疗计划。
在接受双膦酸盐治疗时发生了颌骨坏死的患者应接受口腔外科医生的医治。在这些患者中,治疗颌骨坏死的大型牙科手术会加重该情况。基于个体获益/风险评估,应考虑是否终止双膦酸盐的治疗。
非典型性转子下骨折和骨干股骨骨折
在接受双膦酸盐治疗的患者中,曾报告出现非典型的低能量或低创伤的股骨干骨折。这些骨折可以出现在小转子一下到髁上锥形部的任一处股骨干,且这些骨折的方向为横向或短斜,无明显的粉碎现象。由于这些骨折也出现在未接受双膦酸盐治疗的骨质疏松患者中,因此这些骨折与双膦酸盐并无一定的因果关系。
非典型性股骨骨折最常见的是其受伤区域只有微小的创伤或没有创伤。这类骨折可能是双侧的,且许多患者报告在该区域有前驱疼痛,通常表现为大腿钝痛,前驱疼痛在出现完全性骨折前会持续几周至几个月。一些报告注意到,患者在骨折时也在接受糖皮质激素(如:强的松)治疗。
有双膦酸盐用药史的患者,如果出现大腿疼或腹股沟疼,则有可能出现了非典型性骨折,应接受评估,以排除不完全股骨骨折。表现出非典型性骨折的患者也应该对侧肢体的骨折症状和体征进行评估。基于个体获益/风险评估,应考虑是否终止双膦酸盐的治疗。
肌肉骨骼疼痛
据上市后经验报告,在使用双膦酸盐(被批准用于骨质疏松的预防和治疗)的患者中曾偶尔发生严重的导致功能障碍的骨、关节和/或肌肉疼痛(见[不良反应])。这类药物中包括本品阿仑膦酸钠,多数患者为绝经后女性。自服用药物至症状发作的时间从一天至数月不等。如果出现严重症状,应停用。多数患者停药后症状缓解。重新使用同一药物或其他双膦酸盐后,一些患者可再次出现这些症状。
在本品安慰剂对照临床试验中,阿仑膦酸钠组和安慰剂组发生肌肉骨骼疼痛的患者百分比相似。
矿物质代谢
在开始应用本品治疗之前,必须先纠正低钙血症(见[禁忌])。应对其它影响矿物质代谢的疾病(例如维生素D缺乏)进行有效治疗。对于这些患者,在使用本品治疗期间应监测其血清钙和低钙血症的情况。
由于阿仑膦酸钠可增加骨密度,因此可出现轻度的、无症状的血钙和磷酸盐下降,尤其是患有Paget‘s骨病(其骨转换的预处理率将大大提高)和使用糖皮质激素治疗的患者,可能他们的钙吸收会降低。
因此,对于患有Paget‘s骨病和使用糖皮质激素的患者而言,保证摄入足够的钙和维生素D是很重要的。
肾功能损伤
对于肌酐清除率低于35mL/min的患者,不推荐服用本品。肌酐清除率为35-60ml/min的患者不需要调整剂量。
肝功能损害
因为有证据表明阿仑膦酸钠不在胆汁中代谢或排泄,因此未在肝功能损害患者中进行研究。无需进行剂量调整(见[药代动力学])。
糖皮质激素引发的骨质疏松症
尚未确定本品在糖皮质激素每日治疗剂量少于或等于7.5mg强的松时的风险和益处。治疗开始之前,应确定男性和女性的性腺荷尔蒙状况并考虑合适的替代治疗。
治疗初期应进行骨密度测量,并在联合服用本品和糖皮质激素6到12个月之后重复测量骨密度。
妊娠
本品没有在妊娠女性中进行研究。妊娠期间,只有当证明潜在的治疗益处大于对于母亲和胎儿的潜在风险时才可使用本品。
双膦酸盐吸收于骨基质中,并在数年期间从骨质中逐渐释放。吸附于成人骨中的双膦酸盐量以及可以释放入系统循环的量直接与所用双膦酸盐的剂量和持续时间有关。没有有关人类胎儿风险的数据。但是,如果女性患者在使用一段时间双膦酸盐后妊娠,理论上存在胎儿伤害的风险,特别是对骨骼的影响。对于以下不同因素,例如,停止双膦酸盐治疗到妊娠之间的时间,所使用的双膦酸盐的具体剂量以及给药途径(相对于口服给药而言的静脉内给药)所导致的风险尚未进行研究。
在大鼠中进行的生殖毒性研究表明,当低于临床推荐剂量的一半剂量时,观察到大鼠的着床存活率降低和正常幼仔的体重增加减少。自3倍临床剂量开始,胎鼠骨化不全部位(椎骨(颈椎、胸椎和腰椎)、颅骨和胸骨)统计学上显著增加。妊娠家兔给予约10倍临床剂量时,未观察到对胎兔有上述相似的影响。
妊娠大鼠给予约4倍临床剂量时,大鼠体内的总钙量和钙离子量均降低,从而导致分娩延迟和失败。当大鼠从交配前直到整个妊娠期间均给予十分之一临床剂量时,大鼠会因低钙血症出现分娩延迟。不同时期(给药时间范围从仅在交配前给药到仅在妊娠早期、中期和晚期给药)给予4倍临床剂量时,在雌性大鼠中均观察到母体毒性(妊娠后期大鼠死亡);停止给药后,大鼠死亡减少但仍存在。通过饮水或微型真空泵给予钙补充剂能够改善低血钙状态或防止由于分娩延迟所造成的母体和新生儿死亡;通过静脉内给予钙补充剂能够防止母体死亡,但不能防止胎儿死亡。
药物的暴露量是基于表面积,即mg/m2,并通过人每日40mg的剂量加以计算的。动物给药的剂量范围:大鼠为1~15mg/kg/天,家兔高达40mg/kg/天。
哺乳期妇女
尚不明确阿仑膦酸钠是否能投通过乳汁分泌。因为许多药物能够通过乳汁分泌,因此哺乳期妇女慎用。
本品不适用儿童。
在临床研究中,未发现本品有年龄相关性的疗效和安全性方面的差异,或遵医嘱。
如果同时服用钙补充制剂、抗酸药物和其它口服药物可能会干扰本品吸收。因此,病人在服用本品以后,必须等待至少半小时后,才可服用其它药物。
预计无其它具有临床意义的药物相互作用。
两项为期一或两年的临床研究对绝经后骨质疏松妇女同时应用激素替代治疗(雌激素±孕激素)(静脉同时经皮给药或口服给药)和本品进行了评价。与单独应用相比,联合应用激素替代治疗和本品能更多地增加骨量,更多地降低骨转换。在这些研究中,联合治疗与单独治疗在安全性和可耐受性方面是一致的。
特异性相互作用研究尚未进行。在治疗男性和绝经后妇女的骨质疏松症的研究中,本品已与各种常用处方药同时使用,无明确的临床不良相互作用。
由于非甾体类抗炎药会引起胃肠道刺激,当与阿仑膦酸钠同时使用时应该谨慎。
目前尚没有关于本品过量用药的资料。口服药物过量可能会导致低钙血症、低磷血症和上消化道不良事件,如胃部不适、胃灼热、食管炎、胃炎或溃疡。应给予牛奶或抗酸剂以结合阿仑膦酸钠。由于食管刺激的危险,不应该诱导呕吐,病人应保持直立。
治疗绝经后妇女的骨质疏松症
对骨矿物质密度的影响
四项为期2年或3年疗程的双盲、安慰剂对照的临床研究证明了每日服用本品10mg对绝经后妇女骨质疏松症的疗效。其中包括两项设计完全相同的多中心的、为期3年的研究;一项在美国进行,另一项在 15个国家进行,分别入选了478和516名患者。下图显示了3年时每日用本品10mg的患者相对于安慰剂治疗患者的腰椎、股骨颈和转子的骨密度平均增加百分数。
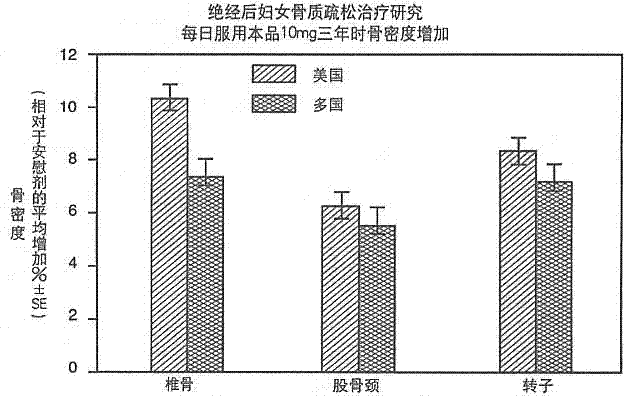
在联合的研究中,3年后用安慰剂治疗的患者的腰椎、股骨颈和转子的骨密度显著降低了0.65%至1.16%。而每个研究中每日服用本品10mg的患者各测定部位的骨密度均有相对于基线和安慰剂患者的极显著增加,同时,在两个研究中他们全身的骨密度也都有明显增加,这表明脊柱和髋部的骨质增加并非是以其他部位的骨质损失为代价的。骨密度的增加在3个月时就已经很明显,并在整个3年期间持续增加而没有明显的平台期(见下图腰椎的结果)。在以上研究的两年延长期中,本品10mg/天治疗使腰椎及转子的骨密度持续增长(3-5年间的绝对增长为:腰椎0.94%;转子0.88%)。因而,本品能逆转骨质疏松症的进程。不论年龄、种族、基线骨更新率、肾功能以及各种常用药物的应用,本品都有相似的疗效。

在另一研究中,本品每天10mg用药2年,患者的腰椎、股骨颈和转子以及全身的骨密度均有相对于鼻内滴入鲑鱼降钙素每天100IU或安慰剂的极显著性的增加。
对于用本品每天10mg治疗1年或2年的绝经后骨质疏松患者,评价了终止治疗的影响。停药后,未见到骨量进一步增加,也未见骨丢失的加快。这些数据表明,坚持本品10mg治疗必须每天连续进行,使骨量递增。
一项为期一年双盲多中心研究表明,本品每周一次70mg(N=519)与每天10mg(N=370)对绝经后骨质疏松的妇女的治疗作用是相当的。一年时腰椎BMD相对于基础值的平均增加,在每周一次70mg组为5.1%(4.8,5.4%;95%CI);在每天10mg组为5.4%(5.0,5.8%;95%CI)。两治疗组在其它骨骼部位的BMD的增加也是相似的。这些资料显示,本品每周一次70mg在降低骨折发生率方面与每天10mg是同样有效的。
对骨折发生率的影响
为评价本品对脊椎骨折发生率的影响,将美国和多国研究结果结合起来分析,比较安慰剂与本品各剂量组(5mg或10mg治疗3年,或者用20mg治疗2年再用5mg治疗1年)的作用。本品治疗的患者发生一次或多次脊椎骨折的比例较安慰剂降低了48%(3.2%比6.2%),并具有统计学意义和临床意义。总脊椎骨折的降低得更明显(4.2比11.3/100名患者)。而且,由于骨折数量和严重程度的降低,用本品治疗的患者发生脊椎骨折时身高降低较少(5.9毫米比23.3毫米)。
另外,汇总五项安慰剂对照的2年或3年疗程美国和多国研究中剂量≥2.5mg的数据(本品1012例,安慰剂590例)进行的分析表明,非脊椎骨折的发生率显著地降低了29%(本品9.0%比安慰剂12.6%)。与对脊椎骨折的影响类似,阿仑膦酸钠的这些治疗结果与所观察到的骨量增加相符。
骨折干预试验包括在绝经后妇女中进行的两项研究:一项为期三年,研究对象在入组时至少有一处脊椎压缩骨折;另一项为期四年,研究对象的骨量低但入组时没有脊椎骨折。
骨折干预试验:三年研究(病人在入组时至少有一处脊椎骨折)
这项随机、双盲、以安慰剂为对照的研究,纳入了2027个病人(本品,1022例;安慰剂,1005例)结果表明,在三年时,本品降低骨折发生率有显著的统计学意义和临床意义(如下表所示)。从上面五组骨质疏松治疗研究可以看出,髋和腕部骨折也呈现类似比例的下降。
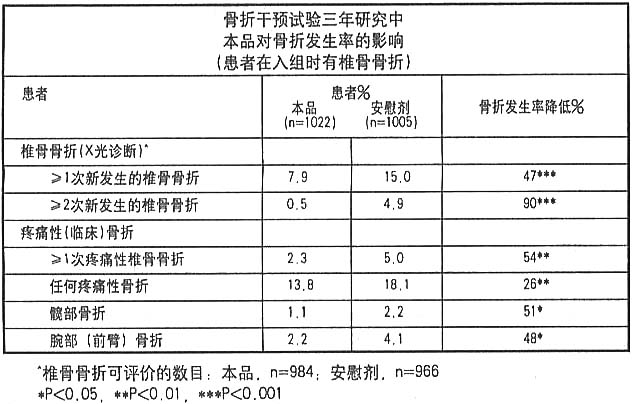
而且,在入组时即有脊椎骨折的病人中,本品治疗能显著降低各种原因住院的发生率(25.0%对30.7%,降低20%),这种差别的出现至少部分与骨折发生率下降有关。
骨折干预试验:四年研究(病人骨量低,但入组时无椎骨骨折)
这项随机、双盲、以安慰剂为对照的实验,纳入了4432个病人(本品,2214例;安慰剂,2218例),其结果进一步表明了本品治疗可降低骨折发生率。这组研究的目的是纳入骨质疏松的妇女,即:研究对象的股骨颈BMD基线值较年轻成年妇女的平均值至少低两个标准差。但是,由于后来对股骨颈BMD正常值的修改,有31%的病人没能满足纳入标准,因而此项研究包括了骨质疏松和非骨质疏松妇女。下表列出了骨质疏松病人的研究结果。

对所有病人(包括没有骨质疏松的病人),骨折发生率下降情况如下:≥1次疼痛性骨折下降14%(P=0.072);≥1次椎骨骨折下降44%(P=0.001);≥1次疼痛性椎骨骨折下降34%(P=0.178),髋部骨折下降21%(P=0.44)。在所有病人中,腕部骨折的发生率,本品组为3.7%;安慰剂组为3.2%(没有显著差异)。
骨折结果的一致性
在降低脊椎骨折发生率方面(本品比安慰剂),骨折干预试验(包括3年和4年两研究)结果与美国和国际多中心研究的结果一致(如上),其中80%的妇女在入组时没有椎骨骨折。在这些研究中,对至少有一处新脊椎骨骨折的妇女,本品治疗可使其所占比例降低约50%(其中,三年骨折干预试验组降低47%,P<0.001;四年骨折干预试验组降低44%,P=0.001;国际多中心组为48%,P=0.034)。另外,对有多处(两处或两处以上)新骨折的妇女,在国际多中心组以及三年骨折干预试验组中,经本品治疗后其所占比例下降约为90%。因此,无论病人先前有无脊椎骨骨折,本品均能降低脊椎骨骨折的发生率。
总的来说,这些结果一致表明,本品能有效地降低骨质疏松性骨折好发部位:椎骨和髋部骨折的发生率。
骨组织学
270名用本品每天1mg至20mg治疗一、二或三年的绝经后骨质疏松症患者的骨组织学检查表明,与安慰剂比较,治疗组出现了正常的骨矿化和结构,以及所预期的骨转化率降低。结合长期给予阿仑膦酸钠的大鼠和狒狒所观察到的正常骨组织学和骨强度增加的结果表明,本品治疗期间形成的骨胳是正常的。
治疗男性骨质疏松症
一项为期两年的双盲、安慰剂对照的多中心临床研究证明了每日服用10mg本品对男性骨质疏松患者的疗效。这项研究共入选了241名年龄在21岁至87岁(平均63岁)的男性患者,每日服用本品10mg的患者两年后相对于安慰剂治疗患者的骨密度平均增加百分数如下:腰椎 5.3%,股骨颈2.6%,大转子3.1%,和全身1.6%(所有P≤0.001)。在这些男性患者中,每日服用本品10mg降低了新脊椎骨折(定量放射照相术检测)的发生率(本品与安慰剂分别为0.8%和 7.1%,P=0.017),也减少了身高的降低(本品与安慰剂身高降低分别为0.6毫米和2.4毫米,P=0.022)。不论年龄、种族、性腺功能、基线骨密度如何,本品 都有效。这与绝经后妇女大规模的研究结果是一致的。
作用机制
动物研究发现本品有下述作用方式。在细胞水平,阿仑膦酸钠对骨吸收部位特别是破骨细胞作用的部位有亲嗜性。正常情况下,破骨细胞粘附于骨表面但边缘并不粗糙,而粗糙的边缘则是骨吸收活跃的标志。阿仑膦酸钠不影响破骨细胞的聚集或粘附,但它确实能抑制破骨细胞的活性。小鼠体内进行的有关标记有放射活性的[3H]阿仑膦酸钠在骨内作用部位的研究显示,破骨细胞表面的摄入是成骨细胞表面的10倍。标记有放射活性的[3H]阿仑膦酸钠分别给予大鼠6天和小鼠49天后,检查其骨组织发现,正常骨形成于阿仑膦酸钠表面,后者与基质结合后不再具有药理活性,因此,阿仑膦酸钠必须持续服用以抑制新形成的吸收表面的破骨细胞。狒狒和大鼠的组织形态测量学显示,阿仑膦酸钠能降低骨转换(即骨重建部位的数量),而且,在这些重建部位,骨形成超过骨吸收,从而使骨量逐渐增加。
动物毒理
急性毒性
对雌性大鼠和小鼠来说,口服阿仑膦酸钠的LD50值分别为552mg/ kg(3256mg/m2)和966mg/kg(2898mg/m2)(相当于人类口服剂量*27600和48300mg)。对雄性鼠,这些值要略高一些,分别为626mg/kg和1280mg/kg。而狗口服剂量达200mg/kg(4000mg/m2)仍未见致死作用(相当于人类口服剂量 *10000mg)。
*以患者的体重为50公斤计
慢性毒性
对大鼠和狗分别进行的长达一年和三年的重复剂量-毒性研究发现,阿仑膦酸钠的相关变化有以下几个方面:在内源性软骨骨形成区保留了最初的松质骨;碱性磷酸酶活性持续下降;血钙和血磷的浓度一过性下降。这些都与阿仑膦酸钠预期的药理活性相关。对肾毒性最敏感的物种(如狗)出现肾毒性的剂量相当于人类至少应用100mg。大鼠需要更高的剂量才表现出这种肾毒性。胃肠毒性只出现在啮齿动物。这可能是由于对黏膜的直接作用,且仅发生在剂量超过2.5mg/kg/天时。
致癌作用
口服给予大鼠阿仑膦酸钠每天3.75mg/kg观察105周以及口服给予小鼠阿仑膦酸钠10mg/kg/天观察92周均未发现有致癌作用。
致突变作用
无论有无代谢活性,体外微生物致突变试验未发现阿仑膦酸钠有致突变作用。同样,体外哺乳细胞致突变试验、体外大鼠肝细胞碱性洗脱试验以及静脉给予小鼠阿仑膦酸钠每天25mg/kg(75mg/m2)体内染色体畸变试验也均未发现其有致突变作用。但是,中国仓鼠卵细胞的体外染色体畸变试验发现:阿仑膦酸钠浓度大于5mM时有弱细胞毒作用,这对人类来说无相关性,因为,体内的治疗剂量不可能达到同样浓度。而且,五项基因毒性研究中有四项都是纯阴性结果,包括与人类致癌可能性最直接相关的研究(体内染色体畸变试验和微生物致突变试验),以及大鼠和小鼠体内的致癌研究阴性结果均表明阿仑膦酸钠对人类没有基因毒性或致癌的危险。
繁殖
口服给予大鼠阿仑膦酸钠每天5mg/kg对两性的生育和繁殖能力都没有影响。这些研究中发现的唯一与药物相关的影响是大鼠分娩困难。这与药物介导的低钙血症直接相关,这种影响可通过给大鼠补充钙来预防。而且,每天1.25mg/kg的剂量没有任何影响。
生长发育
有关生长发育的毒性研究中,给予大鼠阿仑膦酸钠每天25mg/kg和给予兔子每天35mg/kg均未发现有不良影响。
吸收
以静脉剂量作参考,空腹及标准早餐前2小时给予阿仑膦酸钠5-70mg,其平均口服生物利用度在女性为0.64%,在男性口服10mg为0.6%,两者相似。如果在标准早餐前1或1.5小时给药,其生物利用度在两性有类似下降(约40%)。骨质疏松研究证明,在每天第一次进食或喝饮料前至少30分钟给予本品才发挥作用。
如果在标准早餐后2h或2h以上给药,其生物利用度可以忽略不计。阿仑膦酸钠与咖啡或桔汁同服可使其生物利用度下降约60%。
对健康者来说,口服给予泼尼松(20mg每天三次,连用5天)对阿仑膦酸钠的口服生物利用度的影响没有临床意义(平均增加20-44%)。
对于4-16岁的成骨不全(osteogensis imperfecta, OI)患儿,其口服生物利用度与成人类似(见【儿童用药】)。
分布
研究表明,静脉给予大鼠阿仑膦酸钠1mg/kg后,其瞬间分布于软组织,但接着迅速再分布于骨组织或通过尿排泄。其在人体内的平均稳态分布容积,除了骨组织外,至少为28L。口服给予治疗剂量的阿仑膦酸钠由于其在血浆内的浓度过低,难以进行检验分析(小于5ng/ml)。其血浆蛋白结合率约为78%。
代谢
还没有证据表明阿仑膦酸钠在动物或人体内代谢。
清除
一次性静脉给予C14标记的阿仑膦酸钠发现,约50%的放射活性在72小时内由尿排泄,粪便中没有或只有很少量的放射性活性。一次性静脉给予10mg阿仑膦酸钠后测定其肾清除率为71ml/min,全身清除率不超过200ml/min。静脉给药后6小时内其血浆浓度下降95%以上。其在人体内的终末半衰期估计大于10年,这提示阿仑膦酸钠从骨骼中释放。
病人特征
临床前研究表明此药不在骨内沉积而迅速由尿排泄。在动物身上长期累积静脉给药35mg/kg没有发现骨吸收饱和的证据。尽管还没有临床资料,但肾功能受损时,和动物研究的结果一样,阿仑膦酸钠通过肾的清除很可能会下降。因此,当肾功能受损时,阿仑膦酸钠在体内的蓄积可能会增加(见[用法用量])。
15-30℃保存。
铝塑板,每盒1片,每盒2片。
24个月
JX20020177
H20160100
FDA妊娠分级:C