

注射用维库溴铵
万可松® Norcuron®
Vecuronium Bromide for Injection
Zhu She Yong Wei Ku Xiu An
本品主要成分及其化学名称为:维库溴铵
其结构式为:
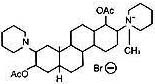
分子式:C34H57BrN2O4
分子量:637.74
本品为白色至类白色粉末或块状物。
本品主要用于辅助全身麻醉,易化气管插管及手术中骨骼肌松弛。
每支含维库溴铵4毫克。
万可松仅供静脉注射使用。
在插管期不论是否使用万可松,为满足平衡麻醉下各种手术的肌肉松弛需要,以下剂量可作为首剂和维持剂量的参考。
插管剂量:万可松0.08-0.1mg/kg。
用琥珀酰胆碱行气管插管后所需的首次剂量:本品0.03-0.05mg/kg。如果应用琥珀酰胆碱插管时,应待对患者临床作用消退后再使用本品。
维持剂量:本品0.02-0.03mg/kg。最好在颤搐高度恢复到对照值的25%时再追加维持剂量。
如其他神经肌肉阻断药一样,其用量应随病人而异。另外,麻醉方法、手术时间、术前或麻醉手术中使用其他药物的影响和病人的状况都需加以考虑。应使用末稍神经刺激器监测神经肌肉阻滞及恢复程度。
或遵医嘱。
最常发生的不良反应(ADRs)包括生命体征的改变和神经肌肉阻滞作用的延长。上市后监测期间最常报告的ADR是过敏和类过敏反应以及相关的症状。参见下表。
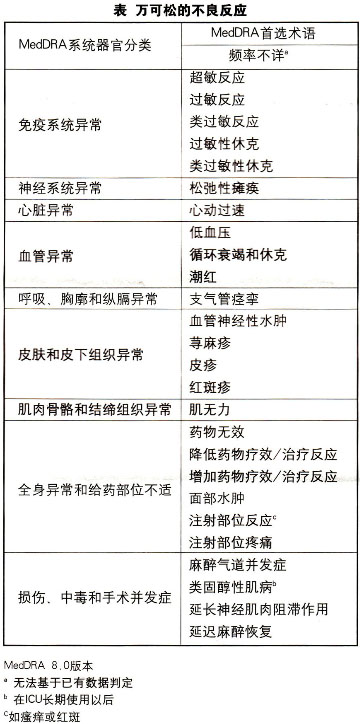
类效应
神经肌肉阻滞作用延长
非去极化阻滞类药物最常见的不良反应是药物的药理作用延长,超过了所需的作用时间。这种作用会有不同的临床表现,从骨骼肌无力到因长时间的深度骨骼肌麻痹而导致呼吸功能不全或呼吸暂停。已有在ICU中联合使用万可松与皮质类固醇后发生肌病的少数病例报告(参见【注意事项】)。
过敏反应
尽管非常罕见,但已有包括万可松在内的神经肌肉阻滞药物产生严重过敏反应的病例报道。过敏/类过敏反应如:支气管痉挛、心血管改变(例如,低血压、心动过速和休克)和皮肤改变(例如血管神经性水肿、荨麻疹)。这些反应在某些病例中甚至是致死性的。鉴于这些反应可能的严重性,临床医生应当始终采取必要的预防措施。
对本品活性成分或任何辅料成分过敏者禁用。
-在肥胖患者(定义为体重超出理想体重的30%或者以上)中,应减少其用量,使用理想体重计算用量。
-吸入麻醉药确实能增强万可松神经肌肉阻滞效果。在麻醉过程中,这种增强效应只有当组织中的挥发性麻醉药达到药效相互作用所需浓度时才具有临床相关性。因此,使用吸入麻醉药1小时以上的手术,应延长万可松给药间隔时间或减缓滴注速度从而给予万可松较低维持剂量。
-如果有必要对患者使用较高剂量,例如紧急外科手术中为防止吸入胃内容物以及禁用琥珀胆碱时,术中同时使用氟烷和神经安定麻醉条件下,维库溴铵首次剂量从0.15mg/kg体重至0.3mg/kg体重均被使用过,并且无心血管不良作用(只要维持适当的通气)。使用较高剂量的万可松缩短了给药后最强神经肌肉阻滞的出现时间,并延长药物作用持续时间。
-剖腹产和新生儿手术的剂量不应超过0.1mg/kg。
由于万可松可导致呼吸肌麻痹,必须进行通气支持,直至患者恢复足够的自主呼吸。
残余箭毒化
与其他神经肌肉阻滞药物一样,已报告万可松存在残余箭毒化作用(即麻醉后神经肌肉阻滞的不完全恢复)。为了预防由于残余箭毒化作用导致的并发症,推荐仅在患者完全从神经肌肉阻滞作用中恢复后再除管。也应考虑到术后除管以后其它可能导致残余箭毒化作用的因素(例如,药物相互作用或患者病情)。如果未按照标准临床操作用药,应该考虑使用拮抗剂,尤其是在那些更易于发生残余箭毒化作用的情况下。
过敏反应
有报道神经肌肉阻滞药物在给药后发生过敏反应。虽然使用万可松发生过敏反应非常罕见,但始终应针对这种反应采取预防措施(参见【不良反应】)。因为神经肌肉阻滞药物之间的交叉过敏反应已有报告,所以,特别是以前对其他神经肌肉阻滞药物有过敏反应的患者,应对其采取特别的预防措施。
心血管作用
万可松在正常剂量范围内预计无心血管副作用。由某些麻醉剂和鸦片制剂和/或因迷走神经反射所引起的心动过缓不会因使用万可松而被减弱。
万可松在重症监护病房(ICU)内的使用
已有报告,通常在重症监护病房(ICU)内长期使用肌肉神经阻滞药物后,会使麻痹和/或骨骼肌无力的时间延长。为了有助于消除可能出现的神经肌肉阻滞延长和/或用药过量,强烈建议在使用神经肌肉阻滞药物的整个过程中监测神经肌肉阻滞情况。另外,患者还应该在神经肌肉阻断过程中接受适当的镇痛和镇静剂治疗。再者,患者的给药剂量应该由熟悉这些药物作用和相应的神经肌肉监测技术的有经验的临床医生或者是在这些医生的指导下滴注至出现反应。
与皮质类固醇联合用药
在ICU中长期给予非去极化神经肌肉阻滞药物联合皮质类固醇治疗后常见肌病报道。因此,对于同时接受神经肌肉阻滞药物和皮质类固醇治疗的患者,应尽可能限制神经肌肉阻滞药物的使用时间(参见【药物相互作用】)。
以下情况可能影响万可松的药代动力学和/或药效动力学:
肝脏和/或胆道疾病
虽然维库溴铵主要通过胆汁排泄,但由万可松诱导产生的神经肌肉阻滞在肝脏和/或胆道疾病患者中的变化较小,且这些变化有剂量依赖性。在这些患者中观察到万可松作用延长,尤其是给予高剂量维库澳铵(0.15-0.2mg/kg体重)时。
肾功能不全
肾功能不全患者使用万可松后观察到药物作用持续时间延长。
循环时间延长
与循环时间延长有关的各种情况,例如,心血管疾病、高龄、水肿等导致分布容量增大,均可能使起效时间延长。由于血浆清除率降低,药物作用的持续时间也可能会延长。
神经肌肉疾病
与其他神经肌肉阻滞药物一样,万可松在用于患有神经肌肉疾病或曾经患有脊髓灰质炎的患者时应该极其谨慎,因为这些患者对神经肌肉阻滞药物的反应可能会发生明显改变。这种变化的幅度及改变方向可能存在很大差异。对于患有重症肌无力或肌无力综合征(Eaton Lambert)患者,小剂量的万可松可能会产生明显效应,因此,应该缓慢滴注万可松直至出现反应为止。
低温
低温下手术,万可松的神经肌肉阻滞效应增加,持续时间延长。
肥胖
与其他的神经肌肉阻滞药物一样,当根据患者的实际体重而非理想体重计算给药剂量时,万可松在肥胖患者中可出现药物作用持续时间和恢复自主运动的时间均有所延长的现象。
烧伤
已知烧伤患者对非去极化药物具有一定的耐受性。因此建议缓慢滴注药物直至出现反应为止。
其他可能使万可松作用增强的情况:
低钾血症(例如,发生剧烈呕吐、腹泻或经过利尿剂治疗后)、高镁血症、低钙血症(经过大量输血后)、低蛋白血症、脱水、酸中毒。高碳酸血症以及恶病质。应尽可能纠正电解质失衡、血液pH值改变或脱水。
对驾驶和操作机械能力的影响
由于万可松是作为全麻的一个辅助治疗,因此对于能走动的患者来说,全麻后应采取常规的预防性措施。
使用本品期间,如出现任何不良事件和/或不良反应,请咨询医生。
同时使用其他药品,请告知医生。
请放置于儿童不能够触及的地方。
目前尚无足够资料证明动物或人在妊娠期使用本品,对胎儿有潜在的危害,但对妊娠期妇女只有经主治医师权衡利弊后才可使用。乳汁中是否含有本品还不清楚。
剖腹产:
研究证明在剖腹产手术中,使用本品不应超过0.1mg/kg是安全的。本品不影响Apgar计分、胎儿肌张力和心、肺的调节能力。脐带血样本的分析证实,只有极少量的本品通过胎盘,对胎儿无任何不良反应。
注意:
因妊娠毒血症使用硫酸镁制剂的病人,在使用本品时,神经肌肉阻断的恢复不满意。这是因为镁盐可强化神经肌肉的阻断效应。因此,对接受硫酸镁治疗的病人,本品用量要减少,并且应根据颤搐反应慎重滴注。
由于儿童神经肌肉接头的敏感性不同,特别是对新生儿(四周以内)和婴儿(四个月以内),首次剂量0.01-0.02mg/kg即可,如颤搐反应末抑制到90-95%,可再追加剂量。在临床手术中,用药剂量不应超过0.1mg/kg。5个月至l岁的婴幼儿所需剂量与成人相似。然而本品在新生儿与婴儿中起效时间较成人与儿童要短。所以,想要缩短插管时间并不需要增加插管剂量。相对于成人与儿童,本品在新生儿与婴儿中作用及恢复时间较长,维持剂量应酌减。
在儿科的应用:
-新生儿和婴儿
氟烷麻醉下新生儿和婴儿的ED90与成人的大致相同(≈28μg/kg)。新生儿和婴儿的起效时间较儿童和成人短,这可能是由于循环时间短和心输出量相对较大,而且前者的神经肌接头对肌松药较敏感。新生儿和婴儿的作用和恢复时间较成年人长,故本品的维持剂量应相应减少。
-儿童
氟烷麻醉下儿童的ED90比成人的高(≈32μg/kg),但统计学无显著差异。与成人相比,其作用和恢复时间分别减少30%和20-30%。与成人类似,在小儿患者中,当颤搐高度恢复至对照值的25%时,重复追加初始剂量的1/4作为维持用药。本品重复给予维持剂量不会发生蓄积作用。尽管在新生儿及婴儿中其恢复时间较长,但并不需要常规使用拮抗剂。如果应用拮抗药,将与成人一样有效。
如患有心血管疾病、高龄、水肿等会导致分布容量增加,均可能延长起效时间。
以下药物能够影响非去极化神经肌肉阻断药的作用强度和(或)作用时间:
作用增强
·麻醉药
-氟烷、乙醚、安氟醚、异氟醚、甲氧氟烷、环丙烷
-大剂量硫贲妥钠、甲乙炔巴比妥、氯胺酮、芬太尼、γ--羟基丁酸、乙醚酯、异丙酚
·其他非去极化类肌肉松弛药
·应用琥珀酰胆碱后
·其他药物
-抗生素 氨基糖苷类和多肽类抗生素、酰氨青霉素类、四环素、大剂量的甲硝唑
-利尿剂 β-肾上腺素能阻滞剂、硫胺素、单胺氧化酶抑制剂、奎尼丁、鱼精蛋白、α-肾上腺素能阻滞剂、镁盐、钙通道阻滞剂、锂盐等
作用减弱
-新斯的明、腾喜龙、吡啶斯的明、氨基吡啶衍生物
-长期使用皮质甾类药物、苯胺类或卡马西平
-去甲肾上腺素、硫唑嘌呤(仅有短暂、有限的作用)、茶碱、氯化钙
作用改变
使用本品后,再给以去极化肌肉松弛药,如琥珀酰胆碱,可能加强或减弱本品的神经肌肉阻断作用。
在用药过量及神经肌肉阻滞延长的情况下,病人应给予机械通气,并给予适量的胆碱脂酶抑制剂(如:新斯的明、吡啶斯的明、腾喜龙)作为拮抗剂。当使用胆碱脂酶抑制剂不能回复本品的神经肌肉作用时,机械通气应延续至自主呼吸恢复。反复使用胆碱脂酶抑制剂是危险的。
本品为竞争性非去极化肌肉松弛剂,通过竞争胆碱能受体起阻断乙酰胆碱的作用。其作用可以被新斯的明等抗胆碱脂酶药所逆转。在初始剂量情况下,产生的肌肉松弛持续时间较短,恢复快。不诱发组胺释放,不引起支气管痉挛和血压下降等。
药动学符合二室开放模型,分布t1/2约为4分钟,消除t1/2约为30-80分钟,平均稳态血药浓度为0.137ug/ml。给药后约1-3分钟肌肉开始松弛,持续20-30分钟。
静脉注射后,其分布半衰期大约为2.2(±1.4)分钟。主要分布于细胞外液,稳态时,其分布容积成人平均为0.27L/kg,其血浆清除率为5.2(±0.7)ml/kg/min。血浆清除半衰期平均为71(±20)分钟。其代谢程度相对较低。人体胆汁和尿中的3-羟基衍生物是其代谢产物,肌松效力大约为本品的50%。在无肝衰或肾衰的病人中,这种代谢产物的血浆浓度极低。
主要以原形和代谢物的形式经胆汁排出,小部分由肾脏排出。大约40~80%以单季铵形式经胆汁排泄,其中95%为本品原型,5%为3-羟基溴化维库溴铵。因由肾脏排出很少,经膀胱内插导管收集到的24小时尿量,平均含有30%的静注溴化维库溴铵。
本品应在25℃以下,避光保存。
本品溶液的配制和稀释应遵循使用指南,配制好的溶液可在室温(15-25℃),日光下保存。
包装规格:每盒50支,另有50安瓿,每安瓿含有1ml注射用水(溶剂)。
包装规格:每盒5支,另有5安瓿,每安瓿含有1ml注射用水(溶剂)。
包装材料:无色玻璃瓶(欧洲药典Type I)
36个月。
配制或稀释后所得液体在室温(15-25℃),日光下可保存24小时。如不能保证绝对严格的无菌操作,液体保存不得超过12小时(15-25℃)。但是,为了避免微生物感染,开封的安瓿(瓶)内不用的剩余药物应弃之。
安瓿(瓶)标签上“valid to……”后的日期为失效期,药物可在此之前使用。
进口药品注册标准JX20000348
进口药品注册证号:H20100383
FDA妊娠分级:C