

麦格司他胶囊
泽维可 ZAVESCA
Miglustat Capsules
maigesitajiaonang
本品主要成分为麦格司他。
化学名称:(2R,3R,4R,5S)-1-丁基-2-羟甲基-3,4,5-哌啶三醇
化学结构式: 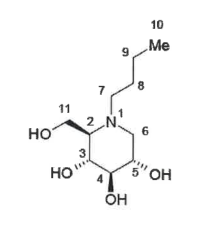
分子式:C10H21NO4
分子量:219.28
本品内容物为白色或类白色粉末。
葡萄糖神经酰胺合成酶抑制剂
本品用于成人及儿童C型尼曼匹克病患者的进行性神经症状的治疗。
100mg
本品应在具有C型尼曼匹克病治疗经验的医师指导下用药。
给药方法
本品可与食物同服或单独使用。
剂量
成人及青少年患者(12岁以上):每次0.2g、每日三次。
12岁以下儿童患者:根据体表面积调整剂量,剂量调整如下表所示:

出现腹泻的患者必须暂时性地降低剂量。
使用本品进行治疗的患者应定期评估其治疗的益处(见【注意事项】)
对于年龄小于4岁的C型尼曼匹克病患者本品的使用经验有限。
老年人
尚无70岁以上患者使用本品的经验。
肾功能损伤患者
药代动力学数据显示,肾功能损伤患者麦格司他的全身暴露量升高。校正肌酐清除率为50-70ml/min/1.73m2的患者,给药剂量应从每次0.2g、每天两次开始(12岁以下患者应根据体表面积做相应的调整);校正肌酐清除率为30-50 ml/min/1.73m2的患者,给药剂量应从每次0.1g、每日两次开始(对于12岁以下的患者应根据体表面积做相应的调整);严重肾功能损伤(校正清除率<30ml/min/1.73m2)患者,不推荐使用本品。
肝功能损伤患者
本品尚未在肝功能不全的患者总进行过评估。
取出胶囊的方法
1. 在齿孔处分开
2. 按箭头方向剥离包装纸
3. 从透明泡罩中推出胶囊
安全性特征总结
本品在国外临床研究中报告的最常见的不良反应是腹泻、肠胃胀气、腹痛、体重减轻和震颤。(见【注意事项】)
在11项不同适应性的临床试验中,共有247名患者使用本品进行治疗,剂量为每次50-200mg、每日三次,平均治疗周期为2.1年。其中132名1型5戈谢病患者,40名C型尼曼匹克病患者。报告的不良反应通常为轻度至中度,各适应症和各剂量组的发生频率类似。
不良反应列表
来自国外临床试验和自发报告的发生于>1%的患者的不良反应,按系统器官分类和发生频率列在下表中(十分常见:≥1/10,常见,:≥1/100至<1/10,偶见:≥1/1000至<1/100,罕见:≥1/10000至<1/1000;十分罕见:<1/10000)。在同一发生频率的不良反应严重程度降序排列。

不良反应的描述
55%的患者报告了体重减轻,用药6至12个月期间的发生率最为明显。
本品进行的多个适应症的研究中的某些被报告为药物不良反应的事件,如精神症状/体征及血小板减少等,也可能是疾病本身所致。
对麦格司他和本品所含任何一辅料过敏者禁用。
震颤
有报告显示使用本品的临床试验中分别有37%的一型戈谢病患者和58%的C型尼曼匹克病患者出现震颤。1型戈谢病患者的震颤表现为手部夸张的生理性震颤。震颤通常于治疗的第一个月出现,许多病例在给药后1-3个月震颤消失。降低剂量可能于几日内改善震颤,但有时可能需要终止治疗。
胃肠道功能紊乱
80%以上的患者在治疗开始时或治疗期间出现胃肠道事件,主要为腹泻(见【不良反应】)。机制很可能为肠道内双糖酶,如胃肠道内蔗糖酶--异麦芽糖酶受到抑制,导致膳食中双糖的吸收减少。在临床实践中发现,麦格司他诱导的胃肠道事件可通过个体化的饮食调整(如减少蔗糖、乳糖以及其他碳水化合物的摄入)、在两餐之间服用本品,和/或合用抗腹泻药物如洛哌丁胺缓解。某些患者有必要暂时性降低剂量。出现慢性腹泻或其它持续性胃肠道事件,且在使用上述方法后情况不能缓解的患者,应按照临床实践要求进行检查。尚未在有明显胃肠道疾病史,包括炎性肠病的患者中对本品进行过评估。
对精子生成的影响
男性患者在服用本品过程中应采用可靠的避孕方法。在大鼠中进行的研究中显示麦格司他对精子生成、精子参数产生不利影响,并会降低生育力,(见【孕妇及哺乳期妇女用药】及【药理毒理】)。在得到进一步信息前,男性患者应在试图生育前停用本品并在停药后3个月内采取可靠的避孕措施。
特殊人群
因用药经验有限,肾功能或肝功能损伤的患者应慎用本品。肾功能与麦格司他的清除率之间有密切关系,重度肾功能损伤患者的麦克司他暴露量显着升高(见【药代动力学】)。目前,对此类患者的临床经验尚浅而无法给出推荐剂量。不推荐重度肾功能损伤患者(肌酐清除率<30ml/min/1.73m2)使用本品 。
C型尼曼匹克病
应定期,如每6个月对C型尼曼匹克病患者使用本品 治疗精神症状的获益进行评估;应在服用本品至少1年后重新评估是否继续使用本品治疗。
在一些使用本品治疗的C型尼曼匹克病患者中可见血小板计数的轻度下降,但未伴随出血。临床试验中有40-50%患者的血小板计数低于正常值下限。推荐对这些患者进行血小板计数监测。
儿科人群
有报道指出一些C型尼曼匹克病的儿童患者在使用本品治疗的早期出现生长发育减慢,起初表现为体重增加的减少同时伴有或在此之后出现身高增加的减少。对使用本品治疗的儿童及青少年患者应进行生长发育监测;必须分别评估治疗的获益/风险比后方可决定是否继续进行治疗。
对驾驶和操纵机器能力的影响
本品可对驾驶和操作机器能力产生轻微影响。报告显示头晕为本品常见的不良反应,故出现头晕的患者不应驾驶或操纵机器。
孕妇
妊娠期妇女使用本品的数据尚不充分。动物试验显示麦格司他具有生殖毒性,包括难产等(见【药理毒理】)
哺乳
尚不明确麦格司他是否会分泌至乳汁中。哺乳期间不应服用本品。
生育力
麦格司他可透过胎盘,所以不应在妊娠期间使用。育龄期妇女应当采取避孕措施。
在大鼠中进行的研究显示麦格司他会对精子参数(如活力和形态)产生不利影响,因此降低生育力。在得到进一步信息前,男性患者应在试图生育前停用本品并在停药后3个月内采取可靠地避孕措施(见【注意事项】【药理毒理】)。
4岁以下的C型尼曼匹克病患者使用本品的经验有限。
尚无70岁以上患者使用本品的经验。
麦格司他不抑制或诱导细胞色素P450酶的各种底物,因此,麦格司他不会与细胞色素P450酶的底物发生显著的相互作用。
临床试验中合用洛哌丁胺没有显示出岁麦格司他药代动力学的显著影响。
由于药物过量所引起的急性症状尚未明确。临床试验中曾对HIV阳性患者给予本品剂量高达每天3000mg、时间长达6个月。观察到的不良反应事件包括粒细胞减少、头晕及感觉异常。在另一组接受每天800mg或更高剂量的患者找那个可见白细胞减少及中性粒细胞减少。
如发生药物过量,推荐进行一般的医疗护理。
C型尼曼匹克病是一种非常罕见的、进行性的并且最终致死的神经退行性疾病,以细胞内脂质运输障碍为特征。神经症状被认为是继发于鞘糖脂类在神经元细胞和神经胶质细胞中的异常储蓄。
支持本品治疗C型尼曼匹克病的安全性和有效性数据来源于在国外完成的一项前瞻性的开放临床试验以及一项回顾性研究。
临床试验(OGT918-007)
本试验入选了29名成人及青少年C型尼曼匹克病患者,在12个月的对照试验期(本品治疗组:n=20;无治疗组:n=9)后又进行了延长治疗,总平均治疗周期为3.9年,最长达5.6年。此外,在非对照组的亚试验中入选了12名儿童患者,总平均治疗期为3.1年,最长达4.4年。41名参加试验的患者中有14名患者使用麦格司他治疗超过3年。成人患者中麦格司他剂量为每次200mg、每日三次,儿童患者的计量根据体表面积进行了相应调整。
主要终点评估了水平扫视眼动(HSEM)速度相对基线值的改变,表述为HSEM-α。麦格司他组患者出现一些改善(HSEN-α较基线值降低),无治疗组则出现恶化。麦格司他组儿童患者与基线值相比亦出现改善。
通过使用评定量表评价患者对水及不同粘度食物的吞咽功能。相比无治疗组,麦格司他组座患者的吞咽功能能够更好地维持(12个月后任何恶化的相对风险:0.4[95%CI0.13,1.22,p=0.17])。总的来说,约80%的成人/青少年患者及儿童患者经过本品治疗24个月后其吞咽功能至少能够保持稳定。
使用豪泽尔标准运动指数(SAI)对运动障碍进行评价。对成人/青少年患者进行的为期12个月的对照试验中,相比无治疗组,麦格司他组患者的行动能力 能被更好地维持(SAI均值相比基线值恶化更低)(麦格司他组:0.087[95%CI-0.287,0.461],无治疗组:0.802[95%CI0.220,1.385],治疗效果(考虑了基线值、中心及治疗的ANCOVA):-0.715[95%CI-1.438,0.007,p=0.052])。使用本品治疗两年后,三分之二的成人/青少年患者及儿童患者至少能够保持其行动能力的稳定。
通过测定成人/青少年患者的Folstein简易精神状态检查(MMSE)计分较基线值的改变来评估认知能力。结果显示在为期12个月的对照试验中麦格司他组结果更有利(麦格司他组:1.219[95%CI-0.060,2.498],无治疗组:-0.352[95%CI-2.213,1.510],治疗效果(考虑了基线值、中心及治疗的ANCOVA):-1.571[95%CI-0.692,3.834,p=0.165])。
本品在治疗C型尼曼匹克病儿童患者中获取的数据与成人和青少年患者对照试验的结果完全吻合。
回顾性研究(Stage I Survey)
一项回顾性研究提供了支持本品有效性的额外数据。此研究分析了66名C型尼曼匹克病患者病例,这些患者使用本品治疗的平均时间为1.5年,且治疗前经过了平均3.1年的观察期。该数据集纳入了儿童青少年及成人患者,年龄范围为1-43岁。通过对吞咽、行动(辨距障碍/张力障碍)、语言/发音等功能,和一项已发表的C型尼曼匹克病残疾量表来评价疾病进展。与治疗前相比,在所有功能及总计残疾方面,使用本品治疗后的年度进展速率均发生具有临床相关的降低。
应定期,如每6个月对C型尼曼匹克病患者使用本品治疗神经症状的获益进行评估;应在服用本品至少1年后重新评估是否继续使用本品治疗(见【注意事项】)。
药理作用
麦格司他是一种葡萄糖神经酰胺合成酶的抑制剂,该酶是大多数鞘糖脂类合成的一系列反应的起始酶。
C型尼曼匹克病是一种细胞内脂质运输受损为特征的神经退行性疾病。神经症状被认为是继发于糖鞘脂类在神经元细胞和神经胶质细胞内的异常蓄积。C型尼曼匹克病小鼠模型经口重复给予麦格司他,发现神经症状(意向性震颤及运动失调)发生延迟,生存期延长,小脑细胞结构得以维持,大脑中神经节苷脂的蓄积被抑制。
毒理研究
重复给药毒性
大鼠连续4周经口给予麦格司他180、840、4200mg/kg/天,在给药剂量>180mg/kg/天(以体表面积计,为人体治疗暴露量的6倍)的动物中观察到脑白质的空泡样表现有时候可能是由于样本处理过程的人为因素儿导致的。
大鼠连续52周经口给予麦格司他180、420、840、1680mg/kg/天,在给药剂量>180mg/kg/天(以AUC计,为人体治疗暴露量的4倍)的大鼠中出现了白内障。
犬连续2周经口给予麦格司他85、165、495、825mg/kg/天,在给药剂量>495mg/kg/天(以体表面积计,为人体治疗暴露量的50倍)时出现了共济失调,瞳孔反射、眼睑反射及髌骨反射减弱或消失。
犬连续4周经口给予麦格司他35、70、105、140mg/kg/天,在105mg/kg/天组(以体表面积计,为人体治疗暴露量的10倍)出现震颤以及角膜反射消失。
猴连续52周经口给予麦格司他750、2000mg/kg/天,在给药剂量≥750mg/kg/天(以AUC计,为人体治疗暴露量的4倍)时中枢神经组织标本(脑脊髓)中发现了血管钙化、脑白质钙化及坏死。
犬连续2周经口给予麦格司他85、165、495、825mg/kg/天,在给药剂量>85mg/kg/天时出现胃肠道坏死、炎症及出血的症状。大鼠连续26周经口给予麦格司他300、600、1200mg/kg/天,在1200mg/kg/天(以AUC计,为人体治疗暴露量的7倍)动物中同样出现了类似胃肠道毒性症状。猴连续52周经口给予麦格司他750、2000mg/kg/天,在给药剂量≥750mg/kg/天(以AUC计,为人体治疗暴露量的6倍)动物中同样出现了类似胃肠道毒性症状。
遗传毒性
麦格司他Ames试验、人淋巴细胞染色体畸变、中国仓鼠卵巢哺乳动物细胞基因突变及小鼠微核试验结果均为阴性。
生殖毒性
生育力和早期胚胎发育毒性试验:雌性大鼠从交配前14天知道妊娠17天经口给予麦格司他20、60、180mg/kg/天,中、高剂量组可见活产数减少,包括整窝丢失和胎仔体重降低(以体表面积计,高剂量时的暴露量≥2倍人体治疗暴露量)。
妊娠兔在妊娠期第6~18天经口给予麦格司他15、30、45mg/kg/天组(以体表面积计,暴露量低于人体治疗暴露量)可见孕兔死亡以及体重增量减少。
围产期发育试验:妊娠大鼠从妊娠第6天到哺乳期(产后第20天),经口给予麦格司他20、60、180mg/kg/天,可见中剂量和高剂量组(以体表面积计,暴露量≥2倍人体治疗暴露量)大鼠出现难产和分娩延迟。此外>20mng/kg/天(以体表面积计,暴露量低于人体治疗暴露量)时可见活产数降低以及幼鼠体重降低。
致癌性
CD-1小鼠连续104周经口给予麦格司他210、420、500mg/kg/天(以体表面积计,分别相当于人体推荐剂量的3、6与7倍)。各剂量组雄性小鼠和中高剂量组雌性小鼠可见大肠粘液腺癌。CD-1小鼠中罕见腺癌发生,是在雌雄小鼠出校大肠炎症与增生性病变的同时出现的。
SD大鼠连续100周经口给予麦格司他210、420、500mg/kg/天(以体表面积计,分别为人体推荐剂量的1、2与5倍),可见睾丸间质细胞癌发生率增加。
据国外文献报道:
麦格司他的药代动力学参数是在健康受试者、1型戈谢氏病患者、法布雷病、HIV感染的患者,以及患有C型尼曼匹克病或3型戈谢氏病的成人、青少年及儿童患者中进行评估的。
麦格司他的动力学显示出具有剂量线型及时间非依赖性。
吸收
在健康受试者中,麦格司他被快速地吸收。给药后约2小时达到最大血浆浓度。其绝对生物利用度尚未确立。与食物同服会降低其吸收率(Cmax降低36%,tmax延迟3小时),但对麦格司他的吸收程度并无统计学意义的显著影响(AUC降低14%)。
分布
麦格司他的表观分布容积为83L。麦格司他不与血浆蛋白结合。
排泄
麦格司他主要经肾脏排泄,以原型药形式排出的药物占给药剂量的70%`80%。口服给药后的表观消除率(CL/F)为230±39ml/分。平均半衰期为6-7小时。
健康志愿者服用单剂量100mg14C标记的麦格司他后,分别有83%和12%的放射活性在尿液和粪便中回收。在你熬夜挤粪便中可检测出部分代谢产物。尿液中最多的代谢产物为葡萄糖醛酸麦格司他,占剂量的5%。血浆中放射活性的终末半衰期为150小时,提示可能存在一种或多种具有超长半衰期的代谢产物。这些超长半衰期的代谢产物尚未被鉴定,但可能发生累积并达到超过稳态时麦格司他代谢产物的浓度。
与健康受试者相比,麦格司他在成人1型戈谢病患者中与C型尼曼匹克病患者中的药代动力学相似。
特殊人却的药代动力学
儿童
药代动力学数据来自于年龄为3-15岁的3型戈谢病的儿童患者以及年龄为5-16岁的C型尼曼匹克病患者。每次200mg、每日三次的剂量按照体表面积进行调整后给予儿童患者,其Cmax及AUCt的值约为服用每次100mg、每日三次剂量的1型戈谢病患者的2倍,这与麦格司他的药代动力学特征呈剂量线型相一致。稳态时,麦格司他在6名3型戈谢氏病患者中的脑脊液浓度为其血浆浓度的31.4%-67.2%。
肾功能损伤
来自肾功能损伤和法布雷病患者的有限数据显示,伴随肾功能下降,CL/F减少。虽然轻度及中度肾功能损伤患者的数量非常少,但数据显示肾功能轻度及中度损伤患者的CL/F分别降低约40%及60%(见【用法用量】)。目前仅有两名严重肾功能损伤的患者数据,期肌酸肝清除率范围是18-29ml/min,但不能外推低于此范围。这些数据提示严重肾功能损伤患者的CL/F至少降低70%。
人口统计变量
所有已知数据表明,麦格司他的药代动力学与人口统计变量(年龄、体重指数BMI、性别或种族)之间不存在显著关系或变化趋势。
肝功能损伤、老年人
尚未获得肝损伤患者或老年患者(>70岁)的药代动力学数据。
密闭,不超过30℃保存。
铝塑包装,84粒/盒
60个月
进口药品注册标准JX20130040。
注册证号 H20160635