

阿德福韦酯片
阿甘定
Adefovir Dipivoxil Tablets
A De Fu Wei Zhi Pian
本品主要成份为阿德福韦酯,其化学名为:9-[2 - [[二[(新戊酰氧基)甲氧基]磷酰基]甲氧基]乙基]腺嘌呤。
本品为白色或类白色片
适用于治疗有乙型肝炎病毒活动复制证据,并伴有血清氨基酸转移酶(ALT或AST)持续升高或肝脏组织学活动性病变的肝功能代偿的成年慢性乙型肝炎患者。
每片10mg
患者必须在有慢性乙型肝炎治疗经验的医生指导下使用本品。
对于成人(18~65岁),本品的推荐剂量为每日1次,每次1片(10mg),饭前或饭后口服均可。治疗的最佳疗程尚未确定。勿超过推荐剂量使用。患者应当定期监测乙型肝炎生化指标、病毒学指标和血清标志物,至少每6个月1次。
文献报道,国外临床研究中常见不良反应为虚弱、头痛、腹痛、恶心、(胃肠)胀气、腹泻和消化不良。
国内临床研究中,经研究者判断可能与药物相关的不良事件如下:脱发、皮疹、头晕、头痛、肝区痛、两肋胀、胃部不适、乏力、恶心、实验室检查异常(ALT、CPK升高,白细胞减少),任何单个不良事件的总体发生率均≤2%。未见与药物相关的严重不良事件。
阿德福韦酯禁止用于已经证实对本品过敏的患者。
病人停止抗乙肝病毒治疗(包括停止使用阿德福韦酯)可能会发生肝炎急性加重。因此,停止抗乙肝病毒治疗的病人应密切监测肝功能,若必要,应重新进行抗乙肝病毒治疗。
对于肾功能障碍或潜在肾功能障碍风险的病人,使用阿德福韦酯长期治疗可能会加重肾功能障碍。这些病人应密切监测肾功能并适当调整剂量。
使用阿德福韦酯治疗前,病人应进行人类免疫缺陷病毒(HIV航体检查)。使用抗乙肝病毒药物,如阿德福韦酯,可能会对慢性乙肝病人携带的未知或未治疗HIV产生作用,也许会出现HIV耐药。
单用核苷类似物或合用其他抗逆转录病毒药物可能会导致乳酸性酸中毒和严重的伴有脂肪变性的肝肿大,包括致命事件。
因为对发育中的人类胚胎的危险性尚不明确,所以建议用阿德福韦酯治疗的育龄妇女要采取有效的避孕措施。
阿德福韦酯在妊娠妇女中的应用没有足够的资料。只有在潜在的受益肯定大于对胎儿的风险时才能考虑在妊娠期间使用阿德福韦酯。
因为对发育中的人类胚胎的危险性尚不明确,所以建议用阿德福韦酯治疗的育龄妇女要采取有效的避孕措施。
本品对孕妇及HBV母婴传播的影响未进行研究。因此,应当遵照标准的推荐方案对婴儿实施预防免疫,以防止新生儿感染HBV。
目前尚不知阿德福韦是否会分泌到人乳,哺乳期妇女使用本品应避免授乳。
阿德福韦酯在18岁以下患者中的疗效和安全性尚未明确,本品不宜用于儿童和青少年。
本品在65岁以上老年患者中的疗效和安全性尚未明确。
阿德福韦酯在体内快速转化为阿德福韦。在浓度显著高于体内观察到的浓度时(>4000倍),阿德福韦对任何一种下列常见的人体CYP450酶都无抑制作用:CYP1A2、CYP2C9、CYP2C19、CYP2D6和CYP3A40阿德福韦不是这些酶的作用底物。但是,尚不清楚阿德福韦是否诱导CYP450酶。根据体外实验的结果和阿德福韦的肾脏消除途径,阿德福韦作为抑制剂或底物,由CYP450介导与其它药物发生相互作用的可能性很小。
阿德福韦通过肾小球滤过和肾小管主动分泌的方式经肾脏排泄。10mg阿德福韦酯与其它经肾小管分泌的药物或改变肾小管分泌功能的药物合用可以增加阿德福韦或合用药物的血清浓度。
10mg阿德福韦酯与100mg拉米夫定合用,两种药物的药代动力学特性都不改变。
10mg阿德福韦酯与经肾小管主动分泌的药物合用时应当慎重,因为两种药物竞争同一消除途径,可能会引起阿德福韦或合用药物的血清浓度升高。
每日服用阿德福韦酯500mg两周和250mg十二周会引起胃肠道不良反应。如果发生过量服药,应对毒性反应进行监测并进行必要的治疗。
如果发生药物过量,必须监测患者是否有中毒的证据,必要时采取标准的支持疗法。可以通过血液透析清除阿德福韦,阿德福韦经体重校正后的血液透析清除率中位数为104ml/min。尚未进行腹膜透析清除阿德福韦的研究。
1.毒理研究:
慢性毒性:
在动物试验中,以组织学改变和/或尿素氮及血清肌酐升高为特征的肾小管肾病,是阿德福韦酯的主要剂量限制性毒性反应。在动物试验中观察到的肾毒性发生的暴露量约为推荐的人治疗量(10mg/天)下的3~10倍。
遗传毒性:
在体外小鼠淋巴细胞瘤试验中(有或无代谢活化),阿德福韦酯有致突变作用。在人外周血淋巴细胞试验中,无代谢活化时,阿德福韦酯能诱导染色体畸变。阿德福韦酯小鼠微核试验结果为阴性,阿德福韦在有或无代谢活化时Ames试验结果为阴性。
生殖毒性:
当暴露量大约为人治疗剂量下暴露量的19倍时,未见对大鼠生育力的影响。大鼠和家兔经口给予阿德福韦酯(暴露量分别约为人治疗剂量10mg/天下的23和40倍),未见胚胎毒性和致畸作用。妊娠大鼠静脉注射给予阿德福韦,在能产生明显母体毒性的剂量时(相当于人体暴露量的38倍),胚胎毒性和胎仔畸形(全身性水肿,眼泡凹陷,脐疝和尾巴扭结)的发生率增加,在静脉注射剂量相当于人暴露量12倍时未见不良影响。
致癌性:
小鼠和大鼠经口给予阿德福韦酯,剂量分别相当于人治疗剂量时暴露量的10倍和4倍时,未见致癌作用。
2.药理作用
作用机制:本品阿德福韦酯是一种口服抗病毒药。阿德福韦酯在体内代谢成阿德福韦,阿德福韦是一种单磷酸腺苷的无环核苷类似物,在细胞激酶的作用下进一步被磷酸化为有活性的代谢产物即阿德福韦二磷酸盐。阿德福韦二磷酸盐通过下列两种方式来抑制HBVDNA多聚酶(逆转录酶):一是与自然底物脱氧腺苷三磷酸竞争,二是整合到病毒DNA后引起DNA链延长终止。阿德福韦二磷酸盐对HBVDNA多聚酶的抑制常数(Ki)是0.1μM,但对人类DNA多聚酶α和γ的抑制作用较弱,Ki值分别为1.18μM和0.97μM。
抗病毒活性:在转染HBV的人肝瘤细胞系中,阿德福韦抑制50%病毒DNA复制的浓度(IC50)为0.2~2.5μM。
耐药性:对接受阿德福韦酯治疗仍然可检测到血清HBVDNA的患者进行了长期耐药性分析(96~144周),确定了rtN236T和rtA181V变异与阿德福韦耐药有关。体外研究发现rtN236T变异导致HBV对阿德福韦的敏感性降低4~14倍,产生这种变异的6/6名患者的血清HBVDNA发生反跳。RtA181V变异导致HBV对阿德福韦的敏感性降低2.5~3倍,产生这种变异的2/3名患者发生反跳。与阿德福韦耐药相关的变异发生率0~48周为0%(0/629),49~96周为2%(6/293),97~144周为1.8%(3/163),3年的累计发生率为3.9%。
交叉耐药性:在HBVDNA多聚酶基因上含对拉米夫定耐药相关突变(rtL180M,rtM2041,rtM204V,rtL180M+rtM204V,rtV173L)的重组HBV变异株,在体外对阿德福韦敏感。在含拉米夫定耐药相关变异HBV的患者中,阿德福韦酯也显示了抗HBV作用,其血清HBVDNA下降的中位数为4.3log10拷贝数/毫升。含DNA多聚酶突变(rtT128N和rtR153Q或rtW153Q,与乙型肝炎免疫球蛋白耐药相关)的HBV变异株,在体外对阿德福韦敏感。体外研究显示,表达与阿德福韦耐药相关的rCN236T突变的HBV对拉米夫定的敏感性降低2~3倍,而与阿德福韦耐药相关的rtA181V突变的HBV对拉米夫定的敏感性降低3倍。
据国外文献报道:阿德福韦酯是活性成分为阿德福韦的前体药物。口服给药后,阿德福韦酯迅速地转化为阿德福韦。健康志愿者与慢性乙肝病人服用阿德福韦酯的药代动力学相似。口服阿德福韦酯10mg阿德福韦的生物利用度为59%。慢性乙型肝炎患者单剂口服本品10mg后达到血药峰浓度(Cmax)的中位数时间为1.75小时(范围:0.58~4.0小时)。Cmax的中位数为16.70(9.66-30.56)ng/ml,AUC0-∞的中位数为204.40(109.75~356.05)ng·h/ml。血浆阿德福韦以二房室方式消除,末端消除半衰期为7.48±1.65h。阿德福韦在浓度范围为0.1~25μg/ml时体外与人血浆或血清蛋白结合≤4%。静脉注射1.0或3.Omg/kg/天稳态分布体积分别为392±75和352±9ml/kg。口服阿德福韦酯10mg、20mg两个剂量组(每组10例,男女各半)的研究结果见下表:
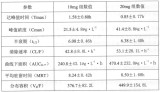
以上结果显示,两个剂量组之间受试者血浆中阿德福韦的Cmax、AUC与给药剂量成正比:Tmax、t1/2、CL/F、MRT、Vd/F无显著性差异,阿德福韦在人体内的过程基本符合线性动力学特征。
10mg、20mg两个剂量组同剂量组男女受试者之间各药代动力学参数大多无统计学意义,显示阿德福韦在人体内的过程无明显的性别差异。阿德福韦在中国受试者的各药代动力学参数与国外文献资料比较接近。
轻度肾损害(肌酐清除率≥50ml/min)对阿德福韦酯的代谢影响不大。中度和重度肾损害病人(肌酐清除率<50ml/min)或肾病末期病人需进行血液透析和调整服药间隔(见下表)。

中度和重度肝损害对阿德福韦酯的药代动力学影响不大,不需调整剂量。
食物不影响阿德福韦酯的药代动力学。
遮光、密封、在阴凉(不超过20℃)干燥处保存。
药用塑料瓶,7片/瓶;10片/瓶;14片/瓶;20片/瓶;30片/瓶。
铝塑包装,7片/板/盒;10片/板/盒;7片/板×2/盒;10片/板×2/盒;14片/板×2/盒。
24个月
注册标准YBH02242007
国药准字H20070198
FDA妊娠分级:C